Activitatea de laborator №6
Obiectiv: dobândirea de abilități prepararea de soluții de diferite concentrații de sare uscată sau o soluție concentrată.
1.Teoreticheskie INTRODUCERE
Soluții joacă un rol important în insufletite și natura neînsuflețite, precum și în știință și tehnologie.
Majoritatea proceselor fiziologice ale corpului uman, animale și plante, diferite procese industriale, procese biochimice din sol, etc. apar în soluții.
Solutia - un sistem multi-component omogen, în care o singură substanță este dispersată într-un alt mediu sau alte substanțe.
Soluțiile pot fi într-un gaz (aer), (aliaje, sticlă colorată) specifică agregate lichide și solide. Cel mai adesea trebuie să lucreze cu soluții lichide.
1. fractie de masa - raportul dintre masa componentei în soluție la greutatea totală a soluției. fracțiunea de masă poate fi exprimată ca o zecimală, procente (%), per mil (miime%) și în părți per milion (ppm # 713; 1). fracțiunea de masă a acestei componente, exprimat în procente, se arată câte grame de component c posedată de 100 g de soluție.
2. Masa de concentrație - raportul masic al componentei conținut în soluția la volumul acestei soluții. Unități de concentrare în masă # 8209; kg / m 3 g / l.
3. TitrT - numărul de grame de solut în 1 ml de soluție. Unități titrului - g / ml, kg / cm3.
4. Concentrația molară a unei - cantitatea de raport substanță (în moli) prezentă în soluția la volumul soluției. Unitățile - mol / m 3 (mol / l). O soluție având o concentrație de 1 mol / l. denota 1M; 0,5 mol / l, desemnat 0,5 M.
concentrație 5. ekvivalentovsek molar (concentrație normală) - raportul dintre cantitatea de substanță echivalentă (mol) la volumul soluției (L). Unitatea de concentrație normală mol / L. De exemplu, SEC (KOH) = 1 mol / l. SEC (1/2 H 2 SO 4) = 1 mol / l, concediat (1/3 AlCl3) = 1 mol / l. În 1 litru care conține 1 mol de echivalenți numite normale și n reprezintă 1.
6. molal b - este raportul dintre cantitatea de solut (în moli) la masa m a solventului. molalitate Unitate - mol / kg. De exemplu, b (HCl / H2O) = 2 mol / kg.
7. Mole fracție - raportul dintre molii de solut la numărul total de moli de solut și solvent. fracție molara poate fi exprimată ca o zecimală, procente (%), per mil (miime%) și în părți per milion (ppm -1).
Pentru prepararea soluțiilor de anumite concentrații, pentru a măsura cu precizie vase volumetrice volumul utilizat: baloane volumetrice. pipete și biurete.
Volumetric Baloanele - Vase plate cu pereți, cu un gât lung îngust pe care este marcat sub forma unei linii inelare. Fiecare flacon a fost desemnat capacitatea și temperatura la care se măsoară această capacitate. Becul trebuie închis etanș cu un dop (Figura 1).
Pipetele sunt utilizate pentru selectarea unui anumit volum de lichid de probă.
Mora Pipetele sunt tuburi de sticlă cu o extensie în mijloc. Capătul inferior este tras în tubul capilar, la marcat capătul superior, la care ar trebui să fie format fluid măsurat. Pe pipetă conține în vrac. Utilizate pe scară largă ca pipete gradate de diferite capacități, pe peretele exterior, care sunt reprezentate grafic divizare. Pentru a umple capătul pipetei inferior al acesteia este scufundat în lichid și ultima remiză sau pere cu ajutorul unui dispozitiv special. câștig de lichid, astfel încât acesta a crescut la 2-3 cm deasupra marca, apoi închideți rapid deschiderea superioară a degetului arătător al mâinii drepte, ținând în același timp degetul mare și degetul mijlociu pipetă. Apoi, slăbiți presiunea degetului arătător, cu rezultatul că lichidul va curge încet din pipetei. La acea vreme, atunci când meniscul inferior (nivelul) lichidului este la același nivel cu eticheta un deget este apăsat din nou. Introducerea picătorul în vasul, ia degetul arătător și pentru a permite fluidului să se scurgă afară din peretele vasului. După ce lichidul este vărsat, cu pipeta 5 secunde încă menținut rezemat de peretele vasului, ușor se rotește în jurul axei sale.
Burette utilizat pentru titrare, pentru a măsura volumele exacte etc.
Fig. 1 măsurare ustensile
și - flacon gradat; b - Pipetă; în - biuretă.
Volumetrica biuretă - un tub de sticlă, cu un capăt inferior de mai multe scoasă sau prevăzută cu o macara. Pe peretele exterior de-a lungul întregii lungimi a biureta fisiune aplicată în 0,1 ml. Prin extremitatea conică Ros pipetă cu un tub de cauciuc de stabilire șirag de mărgele de sticlă. Biureta este umplut cu lichid prin pâlnie. Apoi se deschide robinetul și clemă pentru a umple o parte dintr-o soluție biuretă situată sub macaraua sau clema la un capăt inferior al tubului capilar. Biureta este umplut, astfel încât primul nivel de lichid a fost ușor deasupra diviziunii scării zero. Apoi, cu grijă deschiderea supapei este setat la nivelul zero al diviziunii lichide. Fiecare titrare trebuie inițiată numai după umplerea biuretă la zero.
Pentru măsurarea mai precisă a volumului de lichid folosind mensure și cilindri gradați (Fig.2)
Fig. Baloane de măsurare 2 și pahar
2. EXPERIMENTAL
1. Prepararea soluției de clorură de sodiu EXPERIENȚĂ cu o fracție SARE masă predeterminată (%) diluarea soluției concentrate.
După cum se știe, densitatea - este greutatea unei substanțe pe unitate de volum, # 961; = M / v. Cunoscând densitatea mesei poate determina o soluție fracție de masă (%).
Se determină densitatea soluției poate fi în multe feluri. Dintre acestea, cel mai simplu si rapid - folosind un hidrometru (Figura 3).
Utilizarea sa se bazează pe faptul că corpul flotant este cufundat într-un lichid, atâta timp cât greutatea fluidului dislocuit de acesta nu va fi egal cu masa corpului (principiul lui Arhimede). Extins partea hidrometru inferioară plasată sarcina pe partea superioară îngustă - gât - fragmenta reprezentate grafic care indică densitatea fluidului, în care hidrometru plutitoare. Concentrația soluției de testat găsită folosind datele din tabel în densitatea în funcție de concentrația soluției. Densitatea soluțiilor apoase de clorură de sodiu este prezentată în tabelul 1.
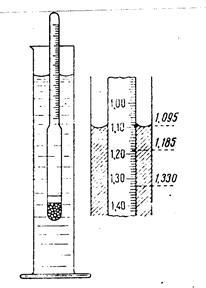
Fig. 3 hidrometru și citirea pe scara lui
Efectuarea de experiență. Cilindrul de măsurare a fost turnat într-o soluție de clorură de sodiu și se determină areometrului densitatea acestuia. Conform tabelului 1 sunt concentrația soluției inițiale [în% (în greutate)].
Numărarea cum trebuie luate multe mililitri de soluție mamă și apă pentru a prepara 250 ml dintr-o soluție de 5%. măsură apă cilindru și se toarnă într-un balon cotat de 250 ml. O soluție stoc de cilindru sare, măsoară 100 ml și se toarnă în vasul cu apă. Soluția în balon s-a agitat. Cilindrul a fost spălată cu un volum mic de soluție a vasului, care este apoi conectat la greutatea totală a soluției în balon. Verificați densitatea și concentrația soluției rezultate. Se calculează eroarea relativă # 948; rel
unde C - o concentrație predeterminată,
C1 - concentrația obținută.
Ia calculul concentrației concentrația molară echivalentă molar și titrului, soluția preparată. Se înregistrează rezultatele în tabelul 2.
O anumită fracție de masă. (%)
densitate # 961;. kg / m3
Masa calculată a componentelor g
Exemplul 1. Se prepară 0,5 I de soluție 20% de H 2 SO 4. baza unei soluții concentrate, care densitate este de 1,84 g / cm3.
Noi calcula cantitatea de pornire de acid și apă necesară pentru a produce un anumit volum de soluție.
Calculăm măsura în care 96% din acidul inițial conținea 114 g de H 2 SO 4.
1 ml de acid inițial cuprinde g H 2 SO 4
x Acid părinte ml conținând 114 g H 2 SO 4
Astfel, pentru prepararea 500ml de soluție 20% de H 2 SO 4 trebuie să ia 64,6 ml soluție 96%.
Cantitatea de apă este definită ca diferența dintre greutățile obținute pornind de soluție, și anume ml
EXPERIENȚA 2. Prepararea soluției de o concentrație predeterminată prin amestecarea unei soluții de concentrații mai mari și mai mici.
O soluție poate fi preparată direct prin introducerea cantității calculate a substanței în solvent, sau prin diluarea unei soluții mai concentrate la o concentrație de o valoare dorită.
EXEMPLUL 2. Se prepară o soluție de 100 g de 36% H 3 PO 4. amestec de 44% și 24% soluții din acest acid.
METODA DE CALCUL I:
Noi notăm cu x numărul de grame de soluție 44%, se adaugă la (100-x) grame de soluție 24% pentru a se obține 100 g de soluție 36% H 3 PO 4. formă ecuația:
Prin urmare, este necesar să se ia 60 de grame de soluție 44% și 100 - soluție x = 24% din 40g.
METODA DE CALCUL II:
Acesta se numește „regula crucii.“ Dacă este lăsat colț al unui dreptunghi imaginar a pus o concentrație mai mare de - 44, iar în stânga jos - concentrație mai mică de -24, iar în centru - concentrația soluției amestecată rezultată - 36 și apoi scăzând diagonala unui număr mai mare de mici, diferența raport 12. 8 = 3. 2 arată, în care raportul în greutate trebuie să fie soluții stoc amestecate pentru a obține concentrația dorită de soluție.
Astfel, pentru a obține o soluție 36% de 100g 60g 44% este suficientă pentru amestecarea soluției și 40 g de soluție 24%.
La determinarea densității de masă soluțiilor stoc - 1,285 g / cm3 (pentru soluția de 24%) consideră că volumele lor sunt, respectiv:
Forma generală a „regulii Crucii“ este după cum urmează:
în care a și b, respectiv, mai mare și concentrație inițială mai mică;
c - concentrația soluției mixte;
- arată, în care raportul în greutate trebuie să fie soluții stoc mixte.
Efectuarea de experiență. Se prepară 250 ml dintr-o soluție de clorură de sodiu 10%, având până la 15% și 5% soluție de NaCI.
Dată fiind densitatea se prepară soluțiile de pornire și se calculează volumul de 15% și soluție 5% (a se vedea. Exemplul 2). Se cântărește volumele calculate ale soluțiilor stoc, golite într-un balon de 250 ml, vasul astupate și soluția a fost amestecată bine prin răsturnare balon de câteva ori cu susul în jos. Se toarnă din soluția preparată în cilindru, un hidrometru pentru a măsura densitatea soluției preparate din tabelul 1 și găsi concentrația sa (în%). Set de divergență, practic, obținută cu o concentrație dată. Se calculează eroarea relativă # 948; rel.
EXPERIENTA 3. Prepararea unei soluții apoase de clorură de sodiu. Determinarea masei fracțiunii ȘI CALCULAREA SUSPENSIE.
Se obține o probă de săruri de clorură de sodiu de instructor. Prin intermediul acestei pâlnii de transfer cântărită într-un balon cotat de 250 ml. Se spală pentru a spăla interiorul pâlniei cu puțină apă. Se dizolvă sarea în apă. Apoi, prin adăugare de apă, în porțiuni mici, pentru a aduce nivelul apei în vasul la semn, balonul cu dop și se amestecă bine, de cotitură cu susul în jos. Hydrometer pentru a măsura densitatea soluției. La această soluție a fost turnată într-un cilindru gradat. Nivelul lichidului trebuie să fie sub marginea cilindrului 3-4 cm. Coborâți cu grijă hidrometrul la soluție. Hidrometru nu trebuie să atingă peretele cilindrului. Numărătoarea inversă nivel de lichid de densitate produc în jos. Conform tabelului 1, localizați și înregistrează fracția greutate (în%) care corespunde densității soluției. Se calculează cantitatea de clorură de sodiu luate pentru a prepara 250 ml de soluție.
EXEMPLU. Lăsați densitatea soluției de clorură de sodiu preparată # 961; = 1,0053g / cm 3. Aceasta corespunde unei concentrații de soluție 1%. Prin urmare, soluția v100g conținea 1g NaCl. Definiți greutatea de 250 ml
Pe baza faptului că soluția conținea 1g 100g NaCl. Știm cât de multe grame de NaCl conținute în soluția 201,315g:
100 g dintr-o soluție - 1 g NaCl
201.315 g soluție - x g NaCl
Astfel, legătura NaCI a fost luată cântărind 2.0131 g