compuși organici acizi și bazici Obiect
Pentru a forma înțelegerea elevilor a impactului proprietăților acide ale compușilor organici, multe fizico-chimice și a proceselor biologice în condițiile corpului.
Învățați elevii pentru a determina proprietățile acide ale alcooli, fenoli, tioli și amine, în funcție de structura lor.
Studentul trebuie să cunoască: tipurile de acizi și baze Bronsted.
Studentul trebuie să poată: determina proprietățile acide și bazice ale compușilor organici.
idei moderne despre acizi și baze. Bronsted și Lowry
Aspecte importante ale reacției compușilor organici este proprietățile lor acide și bazice. Pentru a descrie proprietățile acide și bazice ale compușilor chimici există mai multe teorii - teoria Bronsted și Lowry, teoria lui Lewis și un număr de alții. Cea mai comună este teoria Bronsted și Lowry, sau teoria Protolytic.
Conform Bronsted Theory - Lourikisloty - o moleculă neutră sau ion capabil să doneze un proton (donori de protoni), iar baza - este molecule neutre sau ioni capabili de proton atașarea (proton acceptorii).
Conform teoriei Lewis a acizilor - sunt molecule neutre sau ioni capabile atașarea unei perechi de electroni (pereche de electroni acceptori), iar baza - este molecule neutre sau ioni capabili de a da o pereche de electroni (pereche de electroni donatori).
Aceasta implică faptul că, teoretic, orice compus care include un atom de hidrogen, se poate da un proton și prezintă proprietăți acide. Capacitatea de a dona un proton poate să prezinte nu numai o moleculă neutră, dar particulele încărcate - cationi (NH4 +) și anioni de acizi, cum ar fi HCI, ROH, HSO4 - și altele.
particule care transportă o sarcină negativă, de exemplu C1 - Rolul anioni de bază pot acționa -. OH -. HSO4. NH3. Bazele pot fi molecule neutre, care includ un heteroatom cum ar fi azot, sulf, oxigen, conținând o pereche unshared de electroni, de exemplu alcooli ROH.
molecule neutre sau ioni capabili, în funcție de natura celui de al doilea component prezintă proprietăți acizi sau baze sunt numite amfoter.
Teoria Bronsted - Lowry. acizi și baze Conjugat.
Acizii și bazele prezintă proprietățile lor numai în prezența celuilalt, nici una veschesvto nu va dona un proton în cazul în care sistemul nu are acceptor de protoni - bază și naoborot.t.e. ele formează o pereche acid-bază conjugată în care acidul mai puternic, cu atât mai slab este baza sa conjugată și mai puternică bază, cu atât mai slab acidul său conjugat.
Acid, dând un proton este convertit la baza conjugată și o bază de protoni de acceptare, este transformat în acidul conjugat. Acidul este, de obicei, notată AN, iar baza - în
De exemplu: NS1↔ H + C1 + -. HK1 - acid tare; C1 - ion - conjugat bază slabă;
CH3 COOH ↔ CH3 COO - + H +. CH3COOH - acid slab și CH3 COO - - puternic conjugat ion de bază.
la-ta baze interfațare. interfațare.
Am spus deja că proprietățile acide ale compușilor se găsesc numai în prezența unei baze, iar proprietățile de bază - în prezența acidului, adică, Ea există în anumiți compuși ai acidului - echilibrul de bază, pentru studiu, care este utilizat ca solvent de H2 O. Cu privire la H2O ca acid sau bază definesc proprietățile acide ale compușilor.
Pentru electroliții slabi aciditate cuantificată reacție Kraw, care constă în transferul H + din acidul la H2O ca bază.
-TA th Acid fundații de bază
CH3 COO - - ion acetat, baza conjugată;
H3 O + - ion hidroniu, acidul conjugat.
Folosind valoarea constantei de echilibru al acestei reacții și faptul că concentrația de N2 O este aproape constantă, este posibil să se determine produsul K · [H2O] numit Kkislotnosti aciditate constantă (Ka).
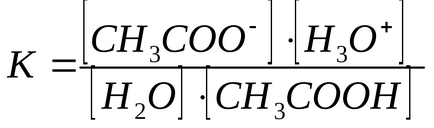
Cu cat mai mare Ka. cu atât mai puternic acid. Pentru CH3COOH Ka = 1,75 x 10 -5. cantități atât de mici, sunt indezirabile în funcțiune practică, prin urmare, exprimat ca Ka pKa (pKa = -ℓgKa). Pentru CH3COOH pKa = 4,75. Cel mai mic pKa. cu atât mai puternic acid.
Concentrația este determinată de bazele rKVN +.