entalpia standard de formare
Când fluxul oricăror reacții chimice au loc ruperea de legături chimice între atomii din molecule de anumite substanțe și formarea de legături chimice între atomii în moleculele altor substanțe. Ruperea legăturilor chimice este legată de consumul de energie, precum și formarea de noi legături chimice rezultate din eliberarea de energie. Suma energiilor tuturor legăturile rupte și toate educați nu sunt egale, astfel încât toate reacțiile să aibă loc fie cu eliberarea sau absorbția de energie. Energia poate fi eliberată sau absorbită sub forma undelor sonore, lumina, expansiune sau contracție de lucru, etc. În cele mai multe cazuri, energia de reacție chimică eliberată sau absorbită sub formă de căldură.
Izolarea sau absorbția căldurii la o reacție chimică se numește căldura de reacție și desemnată de litera Q.
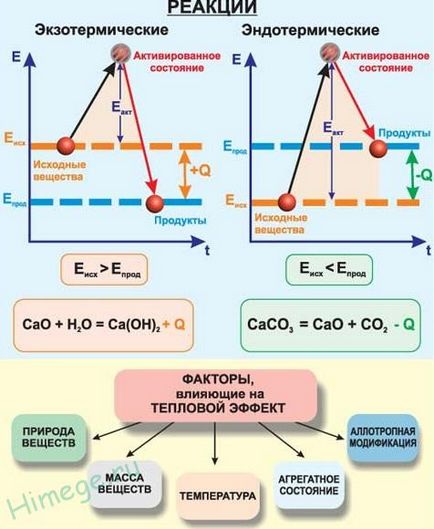
Reacția în cursul căreia căldura este eliberată și transferată în mediu sunt numite exotermă. și cele în curs de care căldura este absorbită de mediul înconjurător, numit endoterm. reacții exotermice pozitiv efect termic responsabil + Q, și endotermă - negativ efect termic -Q.
Ecuațiile reacții chimice, în care este dat căldura de reacție, se numește termochimic. Ecuațiile termochimice indică substanțele la distanță co-agregat (cristalin, lichide, gazoase și t. D.) Și poate fi coeficienți fracționate.
Efectul termic depinde de temperatura și presiunea de reacție, cu toate acestea, tind să-l provoace la condiții standard, adică. E. Temperatura de 298 K și o presiune de 101,3 kPa.
Entalpia standard de formare se calculează prin ecuația termochimică. Reprezentat prin ecuația de mai jos reacție de combustie hidrogen termochimic de oxigen:
H2 (g) + 1/2 O2 (g) = H2O (g) + 286 kJ
Aceasta indică faptul că 1 mol de hidrogen sau ars la 1 mol apa formată se alocă 286 kJ de căldură (Q = 286 kJ, Δ H = -286 kJ). Această reacție este exotermă și se caracterizează printr-un efect termic semnificativ. Nu e de mirare considerat de combustibil de hidrogen efectiv al viitorului.
La formarea oricărui compus este eliberat (absorbit) prin aceeași cantitate de energie ca absorbită (eliberată) în timpul dezintegrarea în materiile prime.
Prin urmare, reacția de descompunere a electrocutării apei necesită energie și costuri este endotermă:
H2O (x) = H2 (g) + 1/2 O2 (g) - 286 kJ (ΔH1 = + 286 kJ).
Aceasta este o consecință a legii conservării energiei.
Cele mai multe calcule termochimice bazate pe cele mai importante legi ale termochimic, care este legea lui Hess. Această lege a stabilit de GI om de știință român Hess în 1840, de asemenea, menționată ca legea de bază a termochimie.
Această lege prevede:
Entalpia standard a formarii depinde numai de stările inițiale și finale ale materiei și nu depinde etapele procesului intermediare.
De exemplu, efectul termic al reacției de oxidare a carbonului (grafit), oxid de carbon (IV) nu depinde de faptul dacă se realizează într-o singură etapă de oxidare (de carbon ardere directă) la dioxid de carbon:
sau reacția începe printr-o etapă intermediară de formare a oxidului de carbon (II):
urmată de afterburning de monoxid de carbon la dioxid de carbon:
In ambele procese, procesul sistemului trece din aceeași stare inițială (grafit), în aceeași stare finală de oxid de carbon (IV). În conformitate cu legea Hess căldura de reacție 1 este suma efectelor termice ale reacțiilor 2 și 3:
Folosind legea Hess poate calcula efectul termic al etapei intermediare de reacție, dacă știm căldura totală de reacție și efectele termice alte stadii intermediare.
Un exemplu de rezolvare a problemei pe un efect termic.
Reacția de oxidare a glucozei in organism poate avea loc după cum urmează:
Care este cantitatea de căldură eliberată în timpul oxidării 800 g de glucoză?
Răspuns. Ca rezultat al oxidării cantității declarat de glucoză eliberat 12,458 kJ de căldură.