Fizica Moleculara 1
Tranziția de la solid la starea cristalină lichidă se numește topire. Pentru a topi corpul solid cristalin, acesta trebuie să fie încălzit la o anumită temperatură, t. E. Sum căldură. Temperatura la care substanța topită se numește punctul de topire de substanță.
Procesul invers - trecerea de la lichid la starea solidă - are loc la temperaturi mai scăzute, adică, căldura este îndepărtată ... Tranziția de la lichid la solid se numește solidificare sau cristalizare. Temperatura la care materialul cristalizeaza, denumit temperatura de cristalizare.
Experiența a demonstrat că orice substanță cristalizeaza și se topește la aceeași temperatură.
Cifra este un grafic al temperaturii corpului cristalin (gheață) din timpul de încălzire (de la punctul A la punctul D) și timpul de răcire (de la punctul D la punctul K). Pe aceasta, axa orizontală reprezintă timpul și verticală - temperatura.
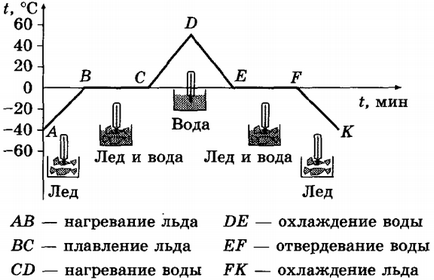
Graficul arată că procesul a început cu punctul de observație în care a fost temperatura gheții -40 ° C, sau, așa cum se spune, temperatura la momentul inițial Tstart = -40 ° C (punctul A din grafic). La încălzirea suplimentară crește temperatura gheții (graficul este zona AB). Creșterea temperaturii are loc la 0 ° C - punctul de topire a gheții. La 0 ° C, gheața începe să se topească și temperatura acestuia încetează să crească. Pe parcursul întregii perioade de fuziune (adică, până când gheața sa topit) temperatura gheții nu se schimbă, chiar dacă arzătorul continuă de ardere și, prin urmare, este furnizată căldură. Procesul de topire corespunde secțiunii orizontale a graficii de soare. Numai după ce toată gheața se va topi si se transforma in apa. temperatura începe să crească din nou (secțiunea CD). Odată ce temperatura apei ajunge la + 40 ° C, stins cu un arzător și apa începe să se răcească, t. E. Căldura este îndepărtată (acest lucru poate fi un recipient de apă, amplasat într-un alt vas mai mare cu gheață). Temperatura apei începe să scadă (porțiunea DE). Când temperatura a atins 0 ° C, temperatura apei încetează să scadă, în ciuda faptului că căldura este încă atribuită. Acest proces de cristalizare este apă - gheață (porțiunea orizontală EF). Până când toată apa se transformă în gheață, temperatura nu se schimbă. Numai atunci începe să scadă temperatura gheții (porțiunea FK).
Vezi graficele este explicată după cum urmează. Pe parcela de aport de căldură datorate AB energia cinetică medie a moleculelor de creșteri de gheață și se ridică temperatura acesteia. Pe întreaga porțiune a conținutului de energie solară primit balonului, este cheltuită pentru distrugerea rețelei cristaline a gheții: o aranjare spațială ordonată a moleculelor sale este dereglată înlocuită, schimbând distanța dintre molecule, adică, rearanjare moleculară are loc astfel încât substanța devine lichid. Energia cinetică medie a moleculelor nu este schimbat, deci rămâne neschimbată și temperatura. Creșterea în continuare a temperaturii de apă cu gheață topită (la CD-ul porțiune) înseamnă o creștere a energiei cinetice a moleculelor de apă datorită arzătorului aport de căldură.
După răcire cu apă (porțiunea DE) din energia a demonstrat, moleculele de apă se deplaseze cu o viteză mai mică, energia lor cinetică medie a picăturilor - scade temperatura, apa este răcită. La 0 ° C (porțiune orizontală EF) molecule incep sa se alinieze într-o anumită ordine pentru a forma rețeaua cristalină. Până când procesul este complet, temperatura substanței nu se va schimba, în ciuda căldurii reziduale, ceea ce înseamnă că lichidul de intarire (apa) eliberează energie. Aceasta este exact energia care consumată gheața, transformându-se într-un lichid (segment BC). Energia internă a lichidului este mai mare decât cea a solidului. După topire (și cristalizare), energia internă a unui organism se schimbă brusc.
Metalele se topesc la temperaturi de peste 1650 ° C, se numește refractare (titan, crom. Molibdenul și altele.). Cea mai mare temperatură de topire între acestea din tungsten - 3,400 ° C. Metale refractare și compușii lor sunt folosite ca materiale rezistente la căldură în inginerie avioane, rachete și spațiu, inginerie nucleară.
Subliniem încă o dată că, în topirea substanței absoarbe energia. În timpul cristalizării de ea, dimpotrivă, îl dă în mediul înconjurător. Da o anumită cantitate de căldură eliberată în cristalizare, mediul este încălzit. Este bine cunoscut pentru multe păsări. De aceea, ele pot fi văzute în timpul iernii, în vreme rece stând pe gheață care acoperă râu și lac. Din cauza eliberarea de energie în formarea de aer de gheață este cu câteva grade mai cald pe ea decât în pădure în copaci, și păsările îl folosesc.
Topirea substanțe amorfe.
Prezența unui punct de topire specific - aceasta este o caracteristică importantă a materialelor cristaline. Pe această bază pot fi distinse cu ușurință de solide amorfe, care sunt, de asemenea, menționate ca solide. Acestea includ, în special, sticlă, plastic rășină foarte vâscos.
substanță amorfă (spre deosebire de cristalin), nu au definit punctul de topire - nu se topesc și se înmoaie. Când piesa de sticlă încălzită, de exemplu, dintr-un prim solid devine moale, poate fi ușor îndoit sau întins; la temperaturi mai mari piesa începe să se schimbe forma sub propria gravitație. Ca încălzirea de masă vâscoasă groasă ia forma vasului în care se află. Această masă este mai întâi gros ca mierea, apoi - ca smântână și în cele din urmă devine aproape același lichid cu vâscozitate redusă, cum ar fi apa. Cu toate acestea, aceste temperaturi specifice de tranziție în stare solidă a lichidului nu este posibilă, deoarece nu există.
Motivele pentru această minciună în diferența radicală a structurii solide amorfe din structura cristalină. Atomii în corpurile amorfe sunt aranjate aleatoriu. corp Amorfe în structura sa seamănă cu un lichid. Deja în atomii solide de sticlă sunt aranjate aleator. Prin urmare, creșterea temperaturii sticlei crește doar fluctuația moleculelor sale, oferindu-le treptat o mai mare și o mai mare libertate de mișcare. Prin urmare, sticla este înmuiată treptat și nu arată o tranziție bruscă „solid-lichid“, caracteristic tranziției de la aranjamentul moleculelor într-o ordine strictă haotic.
Căldura de fuziune.
Căldura de fuziune - cantitatea de căldură care trebuie notificată în substanță la presiune constantă și temperatură constantă egală cu temperatura de topire a se transforma complet dintr-un solid într-o stare de lichid cristalin. Căldura de fuziune egală cu cantitatea de căldură. este eliberată în timpul cristalizării substanței din stare lichidă. Prin topirea întregului furnizat la căldura unei substanțe este de a crește energia potențială a moleculelor sale. Energia cinetică nu se schimba, deoarece topirea are loc la o temperatură constantă.
Studiind experimental de topire diferite materiale de aceeași masă, este posibil să se constate că, pentru a le transforma în lichid necesită o cantitate diferită de căldură. De exemplu, pentru a se topi un kilogram de gheață, 332 trebuie să fie consumat jouli de energie și să se topească 1 kg de plumb - 25 kJ.
Cantitatea fizică. indicând cantitatea de căldură necesară pentru a informa greutatea corporală cristalină a 1 kg. la complet la temperatura de topire se transferă într-o stare lichidă, este numită căldura specifică de topire.
Căldura specifică topirii măsurată în joule per kilogram (J / kg) și notată cu litera grecească X (lambda).
Căldura specifică de cristalizare egală cu căldura specifică de topire, deoarece cristalizarea este alocată aceeași cantitate de căldură care este absorbită la topire. De exemplu, atunci când apa îngheață 1 kg alocate aceleași 332 jouli de energie care sunt necesare pentru a transforma o masă de gheață în apă.
Pentru a găsi cantitatea de căldură necesară pentru topirea cristalină masa corporală arbitrară, sau căldura de fuziune. este necesară căldura specifică de topire a corpului înmulțită cu greutatea sa:
Cantitatea de căldură generată de organism, este considerat negativ. Prin urmare, atunci când se calculează cantitatea de căldură rezultată în timpul cristalizării masa substanței m. ar trebui să folosească aceeași formulă, dar cu semnul „minus“:
Căldura de combustie.
Căldura de combustie (sau valoarea de încălzire de calorii.) - cantitatea de căldură eliberată prin arderea completă a combustibilului.
Pentru încălzire corpurile folosesc adesea energia eliberată prin arderea combustibilului. combustibili convenționali (cărbune, petrol, gaz) conțin carbon. La ardere atomii de carbon se combină cu atomii de oxigen. conținute în aer, rezultând formarea de molecule de dioxid de carbon. Energia cinetică a acestor molecule este mai mare decât cea a particulelor precursoare. Creșterea energiei cinetice a moleculelor în procesul de ardere se face referire la eliberarea de energie. Energia eliberată prin arderea completă a combustibilului și există căldura de ardere a combustibilului.
Căldura de ardere depinde de tipul de combustibil și de masa acestuia. Cu cât mai mare masa combustibilului, cu atât mai mare cantitatea de căldură eliberată în timpul arderii completă.
Cantitatea fizică. indicând cantitatea de căldură eliberată în timpul arderii complete a combustibilului de 1 kg, aceasta se numește căldura de combustie specifică. Căldura de combustie specifică desemnate prin litera q și măsurată în jouli pe kilogram (J / kg).
Q. Numărul de căldură eliberată în timpul arderii combustibilului kg m se determină prin formula:
Pentru a găsi cantitatea de căldură eliberată prin arderea completă a masei arbitrare de combustibil, aveți nevoie de căldura specifică de ardere a combustibilului înmulțită cu greutatea sa.