Lucrările practice - producerea hidrogenului într-un laborator și de a studia proprietățile sale
Lecția Locul de amplasare: clasa a 8-a. Subiect II: oxigen, hidrogen, apa ca solvent.
Tipul de lecție. lucrări practice
- Educație - dezvolta abilități experimentale - tehnici de lucru cu echipamente si materiale de laborator; capacitatea de a observa, trage concluzii, fac din rezultatele muncii practice într-un caiet.
- Dezvoltarea - lucru pe dezvoltarea abilităților de manipulare abila a focului, substanțe periculoase.
- Educațional - extinderea orizonturile elevilor, formarea de respect pentru istoria științei.
- Scoala de sanatate - dezvoltarea de idei despre un stil de viață sănătos în blocuri: „Chimia în viața de zi cu zi - comportament în condiții de siguranță“
Rezultatele așteptate ale învățării:
- Să fie capabil de a lucra cu un dispozitiv automat pentru gaz Kiryushkina
- Pentru a putea colecta gazul prin deplasarea apei
- Pentru a putea verifica puritatea gazului combustibil
- Pentru a putea trage concluziile potrivite din experimentele observate și pentru a caracteriza proprietățile hidrogenului
- Prezentarea multimedia 2 (Microsoft Power Point)
- Haina speciala - halat de baie
- Gradul de ocupare a unui elev tavă de laborator (13 buc.)
- Laborator picior trepied, testare tubul suport raft tub de testare, lingură dozator, hârtie de filtru
- aragaz alcool, se potrivește
- dispozitiv automat Kiryushkina pentru tuburile de gaz 3, matrița cu apă
- granule de zinc, acid clorhidric (dil.), oxid de cupru (II)
- Gradul de ocupare a unei tăvi de laborator pentru profesor:
- pentru tava de student
- căpușă creuzete, sticlă, sticlă placă, baghetă de sticlă
- „Rezultate“ încălcări ale normelor de siguranță
(În italice descrie acțiunile studenților și profesorilor, în special tehnici de lecție, font normal - discursul profesorului)
Punct I. Organizarea (1 min.)
rețineți prezența rochii pentru toți studenții, liber pentru a verifica dacă sacii de pasaje, în cazul în care părul la fete eliminate. Pe mesele lăsați doar pixuri, calculatoare si notebook-uri.
II. Activarea cunoștințele necesare pentru a efectua lucrările practice (13 min.)

În această lecție, vom obține hidrogen în laborator. Această substanță gazoasă; Este exploziv, în cazul în care aerul este poluat, și, prin urmare, necesită o atenție mai mare.
Elevii, în același timp cu discuția pictat în jurnalul de siguranță.

În lecția precedentă, elevii au fost instruiți pentru această lucrare practică (Slide 1) și teme pentru acasă:

Slide manifestă treptat, în conformitate cu conversație
- Care sunt materiile prime, vom folosi pentru producerea de hidrogen?
- Este necesar să se încălzească amestecul de reacție?
- Ce să caute atunci când observarea înregistrarea?
- Ce dispozitiv va fi folosit pentru a produce hidrogen?
- Care sunt câteva modalități în care puteți colecta hidrogen, de ce?
Slide manifestă treptat, în conformitate cu conversație

- Cum să dovedească prezența hidrogenului în tubul-receptor?
- Ce reacție chimică are loc în același timp?
- Ce să caute atunci când înregistrarea observațiilor în această lucrare secțiune?
- Care este gazul detonante?
În cazul în care are loc o explozie într-un vas de sticlă, piesele pot răni pe alții și experimentator.
La testarea purității hidrogenului este ars-un volum mic (aproximativ 15 ml).
Posibil prejudiciu de micro-explozie nu poate conduce.
Regula TB: nu este convingerea că gazul eliberat din dispozitivul curat, păstrați deschiderea tubului de vapori de la o flacără lampă de spirit.
Demonstrarea siguranței reguli rezultate încălcare: tub de testare cu fund de cracare
Regula TB. încălzirea tubului trebuie să fie în punctul în care solidul, mai degrabă decât deasupra - unde aerul. Prin încălzirea neuniformă a tubului se va sparge.
tub cu urme de acid clorhidric într-un amestec cu oxid de cupru (II)
Regula TB: dispozitivul de încărcare automată de acid clorhidric necesar să se aibă grijă să nu se toarnă acidul (max 2 mL), altfel excesul de exotermicitatea procesului și scăderea rapidă în conducta de vapori.
III. Experimentul a profesorilor demonstrație (7 min.)
Profesorul cuvânt cu elemente de conversație

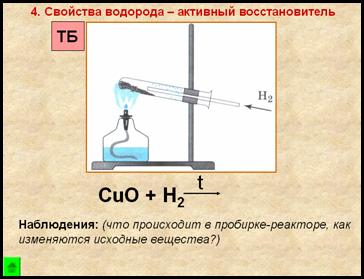
1. Mark lingura de dozare o cantitate mică de pulbere neagră de oxid de cupru (II), plasat într-un tub de testare, lăsat să stea pentru tuburile de testare pentru a efectua experimente asupra proprietăților de recuperare a hidrogenului.
2. Fix instrumentul automat pentru gaz în trepied picior. Charge precursori de unitate: 4-5 granule de zinc pus într-o acid clorhidric cerc cauciuc pâlnie de expansiune, astfel încât stratul de zinc nu a fost mai mult de 2 ml. Dispozitivul este închis cât mai etanș posibil.
3. Pentru a verifica puritatea gazului, trebuie să se pregătească lampa de alcool în prealabil. Lucrezi împreună și aprinde o lampă cu gaz, după spirit va câștiga în receptor probirku-.
Reguli TB: lucrul cu un spirit lampă
a) înainte de a aprinde lampa de alcool, trebuie să verificați dacă discul este strâns la portul rezervorului (în caz contrar scanteia poate cădea în rezervor și întregul volum de alcool va arde)
b) doar un meci la lumina (nu folosiți un, alt spirit lampă brichetă)
c) meciul ar trebui să fie pus în tavă, asigurându-vă că se stinge (demonstrație de siguranță reguli încălcare - durificat tavă)
g) pentru a stinge flacăra, trebuie să închidă capacul (lovitură imposibilă)
Asamblati hidrogen nativ de receptor de susținere tub de deplasare a aerului cu susul în jos. Verificați pentru gaz puritate: clemă tuburi gaură pentru degete și să aducă la lampa de alcool tub de flacără, deschide.
4. Apoi asamblează hidrogen nativ prin deplasarea apei: dial tub plin de apă, rotiți-l în matriță și se aduce la tubul de evacuare a vaporilor. Când tubul receptor este complet umplut cu hidrogen, fixați degetul de deschidere subacvatice. Asigurați-vă că puritatea gazelor.
5. Fixați tubul de testare cu oxid de cupru (II) în suport.
Reguli TB: fixarea tuburilor într-un suport
a) tubul este fixat în porțiunea superioară a treia mai aproape de deschiderea
b) Tubul nu trebuie să coboare, dar se rotesc (în caz contrar, când se dilată încălzite și tubul de sticlă poate exploda)
c) pentru a scoate tubul din suportul, trebuie să slăbiți clema.
Se încălzește lampa flacon spirit flacără de 2-3 ori mai încălzește la partea de sus a flăcării, în locul unde există oxid de cupru (II). Asigurați tubul de vapori pentru a elibera hidrogen.
După încheierea experimentului la tubul de testare să se răcească, apoi se pune într-un stativ pentru eprubete.
6. Stinge lampa de alcool, o eliberare bloc clemă de hidrogen.
Regula de bază a TB: maini sigure la locul de muncă!
IV. Efectuarea de lucrări practice, prezentarea rezultatelor, la locul de muncă de curățare (23 min.)
1. Elevii efectua lucrări practice în mod independent. Profesorul monitorizează corect-ness efectua tehnici experimentale și respectarea normelor de siguranță.
2. Curățarea locului de muncă: după sfârșitul experimentului pentru a studia proprietățile de reducere a hidrogenului:
1 elev: pentru a stinge lampa spirit, da tubul reactorului să se răcească, apoi se pune într-un suport pentru eprubete.
Doilea elev: bloca eliberarea de gaz în dispozitivul automat, îndepărtați pâlnia, reziduurile de zinc plasate pe hârtie de filtru. Scoateți instrumentul din picioarele trepiedului, se toarnă soluția otravă-bot în „Flacon de a se scurge“, trece profesorul de instrumente.
Profesor: tăvi de colectare și forme de turnare cu apă.
Experiența 3. Demonstrarea: studiul produsului de reacție a zincului cu kiclotoy clorhidric
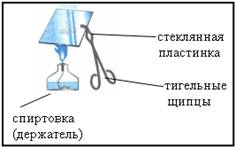
Soluția a fost drenată petrecut în paharul și câteva picături cu o baghetă de sticlă pentru a transfera pe o placă de sticlă. Consolida placa în cleștii de creuzet și se evaporă soluția de flacără
4. Verificați rezultatele experimentului: să formuleze și să scrie în jos observațiile, concluzia (care a aflat de hidrogen gazos în activitatea practică), să predea notebook-ul.
SIDA electronice folosite:
Efectuarea de lucru în caietele de elevi:
Lucrări practice 5: Producerea de hidrogen și studiul proprietăților sale
1. Metodă pentru producerea hidrogenului - interacțiunea dintre metalele active cu acizi.
Zn + 2HCl = ZnCl2 + H2 ↑ + Q - în condiții normale
- reacția dintre granule de zinc cu acid clorhidric este încet la început, apoi foarte rapid, tubul este încălzit
- vaporii eliberați din tuburile de gaz incolor
- prin evaporarea soluției care rezultă este o pulbere de culoare albă pe o placă de sticlă
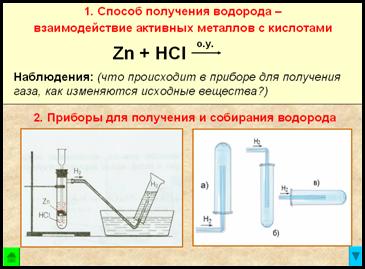
2. Aparat pentru obținerea și colectarea hidrogenului
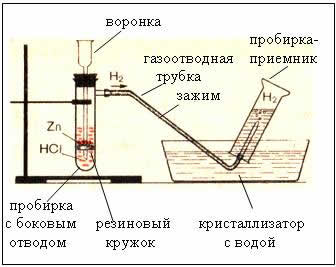
Fig. Dispozitiv de hidrogen - automată, care permite, în orice moment pentru a opri reacția cu o clemă (dispozitiv Kiryushkina).
Ridicarea gazului prin deplasarea apei - probabil pentru că hidrogen ușor solubil în acesta.
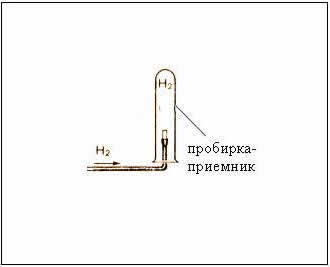
Fig. Colectarea gazelor prin deplasarea aerului - receptor tub de depozit cu susul în jos, pentru că
- prin urmare, mai ușor decât aerul, hidrogenul
3. Detectarea hidrogenului - verificarea purității sale
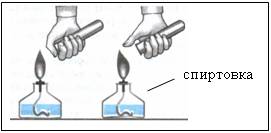
- prin ardere o primă porțiune de gaz este distribuit de sunet lătratul ascuțit
- în timpul arderii a doua porțiuni de gaz se aude bumbac ușor Figura 5 „p-inghinală“
4. Proprietate de hidrogen - reducator activă
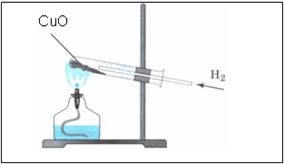
- pulbere își schimbă culoarea de la negru la cupru
- pe pereții tuburilor apar picături lichide incolore
O metodă de producere a hidrogenului în laborator este reacția zincului cu dil. acid clorhidric și sarea formată (clorura de zinc) și hidrogen. Hidrogenul - gaz incolor, inodor, ușor solubil în apă, mai ușor decât aerul, amestecat cu exploziv de aer, recupereaza metalele din oxizii lor.