masa molara de oxigen (o), și exemplele de formula
Molar 1 mol dintr-o anumită substanță, exprimată în grame, se numește său molar (mol) în greutate.
Unitatea de măsură este masa molară g / mol sau kg / kmol. masa molara a substanței în grame este numeric egală cu masa moleculară (atomică), exprimată în unități atomice de masă:
Masa atomică relativă egală cu 15.99903 AMU oxigen atomic Masa sa moleculară relativă este egală cu 15.99903, iar masa molară:
M (O) = Mr (O) x 1 mol = 15.99903 g / mol.
Este cunoscut faptul că molecula de oxigen diatomica - O2. Apoi, masa atomica relativa a moleculelor de oxigen va fi egal cu:
Ar (O2) = 15,99903 × 2 = 31,99806a.e.m.
Masa moleculară relativă a unei molecule de oxigen este egal cu 31.99806, iar masa molară:
M (O2) = Mr (O2) x 1 mol = 31.99806 g / mol, sau doar 32 g / mol.
oxigen gazos este incolor și inodor (diagrama structură atomică prezentată în Fig. 1), slab solubil în apă cu temperatură foarte scăzută de topire (-218,9 ° C) și fierbere (-183 ° C).
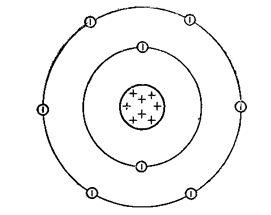
Fig. 1. Structura unui atom de oxigen.
Masa molară a gazului poate fi calculată ca produsul densității sale în raport cu orice alt gaz cu greutatea moleculară a acesteia din urmă. Sub densitate este raportul dintre greutatea unui anumit volum de gaz la masa aceluiași volum de alt gaz (sub aceeași temperatură și presiune), a căror greutate moleculară este cunoscută.
Greutatea moleculară a substanței în stare gazoasă poate fi calculată cunoscând volumul său molar: găsi volumul (STP) ocupat de o greutate specifică a substanței, iar apoi se calculează masa de 22,4 litri de acest material, în aceleași condiții.
Pe lângă aceste metode pentru a determina masa molară a gazului, este posibil să se utilizeze legea gaz ideal (ecuația Mendeleev-Clapeyron), dar această metodă este cea mai puțin exactă a tuturor celor de mai sus.
Exemple de rezolvare a problemelor
Calculați masa de oxigen se obține prin descompunerea oxidului de mercur (II), cântărind 65,1 g