Molecula de apă
Apa (oxid de hidrogen) H2O - simplu compus stabil de hidrogen cu oxigen. 18.0160 Greutatea moleculară a apei, în hidrogen trebuie 11,19% în greutate și oxigen - 88.81%.
Așa cum am menționat anterior, în natură există trei izotopi de hidrogen - 1 H hidrogen ușor deuteriu D (H2) și tritiu (H3) și trei izotopi ai oxigenului - 16 O O O 17 și 18. preparați în mod artificial acceleratoarele izotopi de hidrogen supergreu H 4 și H 5 și șase izotopi de oxigen: trei lumină - o o 13. 14. 15. Cele două grele - 19. o o 20 și o superportavionului - o 24. Teoretic, cinci și nouă de hidrogen izotopi ai izotopilor de oxigen pot forma 135 soiuri de molecule de apă , dintre care nouă sunt stabile care încorporează izotopi stabili. În apă naturală cota Aproximativ 16 au 99,75% în greutate, cota 18 O - 0,2%, la D de 17 - 0,04% și N 1 H 2 O 16 - aproximativ 0,093%; celelalte cinci specii prezente în cantități infime. [4]
Structura apei
Molecula de apă are o structură unghiulară: intră în structura sa nucleu formează un triunghi isoscel, baza din care doi sunt hidrogen si un top - atomul de oxigen. Internuclear distanță O - N aproape de 0,1 nm, distanța dintre nucleele atomilor de hidrogen este de 0,15 nm. Dintre cele șase electroni care constituie stratul extern electronic al atomului de oxigen din molecula de apă, două perechi de electroni pentru a forma o legătură covalentă O-H, iar cele patru electroni rămase sunt două perechi de electroni neîmpărtășite (Figura 1).
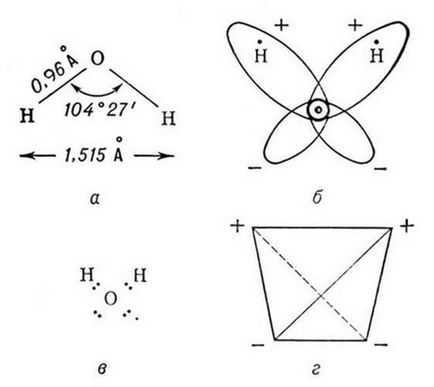
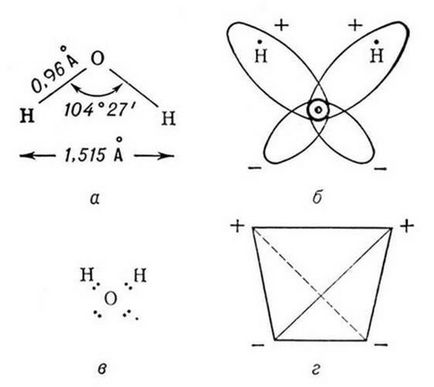
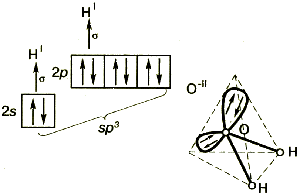
Figura 1 - Modele de structura moleculelor de apă [3]
Molecula de apă este dipol mici, care conțin sarcini pozitive și negative la poli. Aproximativ nuclee de hidrogen există un dezavantaj al densității de electroni și pe partea opusă a moleculei raportată la nucleele de oxigen observat exces de densitate de electroni. Este această structură și determină polaritatea moleculelor de apă. Dacă vă conectați prin linii drepte epicenters de sarcini pozitive și negative, rândul său volum figura geometrică - un tetraedru regulat (Figura 1) [19,20].
Din punct de vedere al formării metodei valență legătură a legăturilor chimice în moleculele de apă pot fi explicate datorită suprapunerii norului două p-one-electron de atomi de oxigen și s-un singur electron nori de doi atomi de hidrogen. Dat fiind că implicat în formarea legăturilor chimice p-nor de oxigen sunt dispuse una în raport cu cealaltă, la un unghi de 90, unghiul de valență HOH trebuie, de asemenea, conform cu această valoare. Cu toate acestea, în realitate, el compune 104,5. Unghiul Bond abatere de așteptat poate fi explicată din două perspective.
Conform uneia dintre ele crește unghiul de legătură de la 90 pentru a explica 104,5mozhno atomi de hidrogen repulsie, care, datorită excepționalei electronegativitatea de oxigen (o diferență de 1,4 pe scara Pauling) iau în molecula de apă cu sarcină pozitivă parțială (plus 0,33 fiecare atom). Atomul efectivă de încărcare de oxigen este de minus 0,66.
Din perspectiva atom de oxigen conceptului de hibridizare trebuie să fie într-o stare de hibridizare sp 3 în care participă doi orbitală cu perechi de electroni nepuse si doua comunicare performante orbitală cu hidrogen. În consecință, unghiul legătură între orbitalii tetraedric aranjate de oxigen în spațiul trebuie să fie de aproximativ 109.5. HOH deviație unghiul legăturii de tetraedric poate fi explicată prin faptul că perechea de electroni a O - volumul H ocupă un spațiu mai mic decât perechea unshared de oxigen [3].
Caracteristici ale structurii moleculelor de apă au consecințe importante.
În primul rând, datorită distribuției inegale a densității de electroni a electronilor de valență H2O moleculă este un dipol cu un pol negativ la pozitiv și oxigenul din atomul de hidrogen. Momentul de dipol al apei este 6.1710 -30 LMC. Aceasta este o valoare destul de mare. Pentru comparație, momentul de dipol este 0 metan, amoniac - 4.4410 -30 CML.
În al doilea rând, mare momentul de dipol al apei este o cauza a dipol-dipol și interacțiunile ion-dipol în soluții apoase.
În al treilea rând, moleculele de apă formează legături de hidrogen.
În al patrulea rând, perechea de electroni unshared de oxigen permite H2O pentru a acționa ca un ligand pentru a forma compuși complecși [3].
Apa are un punct foarte ridicat de congelare (0) și fierbere (100) (Figura 2). Acest lucru îi permite să existe în toate stările de agregare: solid (gheață), lichid (apă) sau gazoasă (de vapori) (Figura 3).
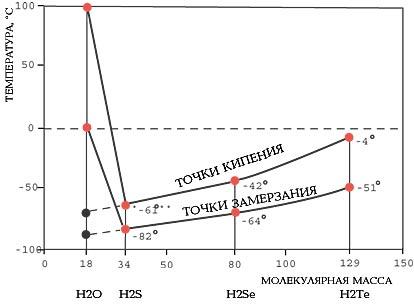
Figura 2 - Anomaliile puncte de fierbere și de congelare

Figura 3 - Stările unităților de apă: A - gheață b - apă în - perechi [2]
De molecule unice de apă se află în stare de vapori. La o temperatură sub punctul de fierbere atunci când energia cinetică a moleculelor devine scadea energia potențială, apă, precum și orice substanță, în acest caz, devine un lichid. Dar temperatura tranziției de fază a apei aproape 200vyshe decât ar fi de așteptat din natura interacțiunilor intermoleculare care trebuie efectuate între similar cu acesta pe moleculă, cum ar fi hidrogenul sulfurat.
Înalta polaritate a apei este doar un motiv pentru asocierea de molecule de apă, care pot fi combinate cu două, trei sau mai multe datorită atracției reciproce a capetelor încărcate opus ale dipol [3].
Principala cauză a formării asociate (H2O) x sunt legături de hidrogen [3]. În stare solidă atomul de oxigen al fiecărei molecule de apă formează două legături de hidrogen (prezentate în fantomă) cu moleculele învecinate prin schema (Figura 4) [4]. Datorită lor, apa lichidă - nu este mișcare dezordonată a moleculelor, iar starea aproape amorfă. In ea moleculele de apă sunt asociate în agregate (H2O) x - gradul de clustere de asociere () si molecule 130 de apă la 0, 90 - la 20, 60 - 72 alineatul (Figura 5) [3].
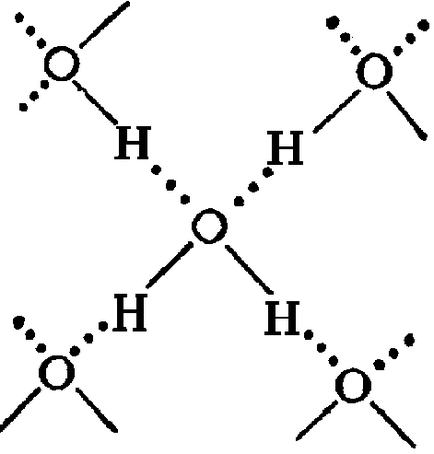
Figura 4 - schema de formarea de legături de hidrogen [4]
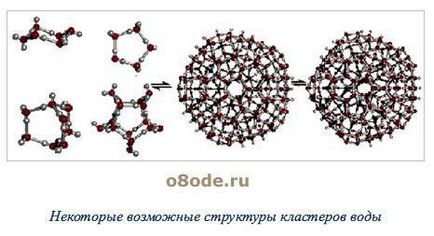
Figura 5 - O parte din posibila structura clusterelor de apă
Durata de viață a acestor grupuri mici (10 -11 - 10 -10 secunde). Educația lor nu este toate moleculele implicate, altfel densitatea acestora în stare lichidă ar trebui să fie la 1 g / cm3 și 1,84 g / cm 3. Această din urmă valoare este calculată pe ipoteza ambalare strânsă a moleculelor H2 O cu o rază egală cu 1 38, care este determinată din rețeaua cristalină a dimensiunii gheții [3].
Schema de rețea cristalină de gheață este prezentat în figura 6. Fiecare moleculă de H2O (bile negre) tetraedric inconjurata de alte patru molecule - trei din același strat și un strat de molecule adiacente. Structura gheata este structura mai puțin densă. Caracteristica sa este prezența golurilor mai mari decât dimensiunile moleculare H2 O. Când gheața se topește o parte din legături de hidrogen este distrusă, iar unitățile rămase în cavitățile pot găzdui moleculele de apă individuale, obținându-se astfel un ambalaj mai dens de molecule. Prin urmare, topirea volumului de apă cu gheață scade și crește densitatea.
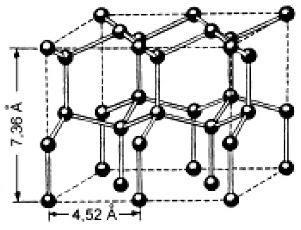
Figura 6 - gheață rețea cristalină [4]