Prin evaporare, fierbere, condensare
Prin evaporare, fierbere, condensare

În stare lichidă substanța poate exista într-un anumit interval de temperatură. La o temperatură mai mică decât valoarea inferioară a acestui interval, lichidul se transformă într-un material solid. Și dacă temperatura depășește limita superioară a intervalului, fluidul trece la starea gazoasă.
Toate acestea putem vedea în exemplul de apă. În stare lichidă, o vedem în râuri, lacuri, mări, oceane, apa de la robinet. Stare solidă de apă - gheață. Acesta este convertit atunci când la presiune atmosferică normală, temperatura scade la 0 ° C și temperatura este ridicată la 100 ° C, apa fierbe și se transformă în abur, care este starea gazoasă.
Procesul de transformare a substanței în abur numit vaporizării. Tranziția inversă de vapori de lichid - condensare.
Vaporizarea are loc în două cazuri: când evaporarea și fierbere.
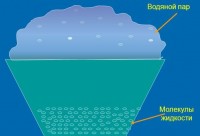
Evaporarea procesului se numește tranziție de fază a unei substanțe dintr-o stare lichidă la o gazoasă sau sub formă de vapori care apar pe suprafața lichidului.
Ca și în topirea când căldura este absorbită prin evaporarea unei substanțe. Este cheltuită pentru a depăși forțele de coeziune ale particulelor (atomi sau molecule) ale lichidului. Energia cinetică a moleculelor care au cea mai mare viteză depășește energia potențială a interacțiunii cu alte molecule de lichid. Datorită acestui fapt, ei înfrâng atracția particulelor învecinate și evacuat din suprafața lichidului. Energia medie a particulelor rămase devin mai mici, iar lichidul se răcește treptat în jos, în cazul în care nu este cald afara.
Deoarece particulele sunt în mișcare la orice temperatură, apoi evaporarea are loc la orice temperatură. Știm că, după băltoace de ploaie seacă chiar și pe vreme rece.
Dar rata de evaporare depinde de mulți factori. Una dintre cele mai importante - temperatura substanței. Cu cât este, cu atât mai mare viteza particulelor și energia lor, iar mai multe dintre ele lasă lichid pe unitate de timp.
Se umple aceeași cantitate de 2 cani de apa. Unul a pus în soare, în timp ce celălalt a rămas în umbră. După ceva timp, vom vedea că apa din primul pahar, a fost mai mică decât în al doilea. Ea a încălzit razele soarelui, și se evaporă repede. Bălți după ploaie în timpul verii și se usucă mult mai repede decât în primăvara sau toamna. Căldura intensă este o evaporare rapidă a apei din iazuri de suprafață. iazuri uscate, lacuri, pat uscat al râurilor de mică adâncime. Cu cât temperatura mediului ambiant, cea mai mare rata de evaporare.
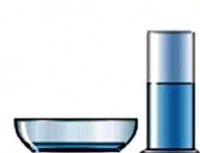
Pentru același lichid de volum găsit într-un vas larg, se evaporă mult mai repede lichid turnat într-un pahar. Aceasta înseamnă că rata de evaporare depinde de suprafața vaporizării. Cu cât suprafața, mai mare numărul de molecule este emis de lichid pe unitatea de timp.
În aceleași condiții de mediu rata de evaporare depinde de tipul de substanță. Umpleți becul de sticlă același volum de apă și alcool. După ceva timp, vedem că alcoolul rămâne mai mică decât cea a apei. Se evaporă într-un ritm mai rapid. Acest lucru se întâmplă deoarece alcoolul moleculele mai slab interacționează unele cu altele decât moleculele de apă.
Aceasta afectează viteza de evaporare și prezența vântului. Noi știm că lucrurile, după spălare, se usuca mult mai repede atunci când vântul îi suflă. Un jet de aer cald uscător de păr poate usca rapid parul nostru.
Vântul poartă moleculele care ies din lichid, și invers, ei nu se mai întorc. Acestea sunt înlocuite cu noi molecule care părăsesc lichidul. Prin urmare, ele devin mai mici în lichidul în sine. Prin urmare, se evaporă repede.
sublimare

Evaporarea are loc în solide. Vedem cum, treptat, se usuca in hainele reci înghețate, acoperite cu gheață. Ice este transformată în abur. Ne simțim miros înțepător, care este format prin evaporarea solidelor naftalină.
Unele materiale nu au o fază lichidă. De exemplu, elementar iod I2 - substanță simplă, care este o formă de cristale de culoare cu un luciu metalic gri violet, în condiții normale convertite imediat în iod gazos - pereche violet, cu un miros înțepător. Iodul lichid, pe care le cumpăra în farmacii - nu este o stare lichidă, și o soluție de iod în alcool.
Procesul de solide se deplasează în stare gazoasă, fără a trece printr-o fază lichidă, numit sublimare ilivozgonkoy.

Se fierbe - este, de asemenea, o tranziție de fluid în abur. Dar vaporizarea la fierbere se produce nu numai pe suprafața lichidului, dar, de asemenea, pe tot volumul său. Mai mult decât atât, acest proces este mult mai intens decât în timpul evaporării.
Puneți fierbătorul pe foc cu apă. Deoarece apa există întotdeauna dizolvat aer în ea, că atunci când este încălzit, în fundul vasului și pe pereții ei sunt bule. Aceste bule conțin aer și abur saturat. Ei au apărut pentru prima dată pe pereții vasului. Cantitatea de abur în ele crește, crește în dimensiune și ei înșiși. Apoi, sub influența flotabilitate Arhimede se vor rupe departe de pereți urca și izbucni la suprafața apei. Atunci când temperatura apei ajunge la 100 ° C, deja bule va fi format peste întregul volum de apă.
Evaporarea are loc la orice temperatură și de fierbere - numai la o anumită temperatură, numită punctul de fierbere.
Fiecare substanță are punctul său de fierbere. Aceasta depinde de presiunea.
La presiunea atmosferică normală, apa fierbe la 100 ° C, alcoolul - la temperatura de 78 ° C, fier - la 2750 C. Un punct de fierbere de oxigen - minus 183 ° C,
Atunci când scade presiunea scade punctul de fierbere. În munți, unde presiunea atmosferica este mai mica, apa fierbe la o temperatură mai mică de 100 C. mai mare altitudine, cea mai mică va fi punctul de fierbere. O oala sub presiune, în care se creează o presiune ridicată, apa fierbe la o temperatură de peste 100 ° C,
Saturate și nesaturate perechi
Dacă o substanță poate exista simultan în lichid (sau solid) și faza gazoasă, stare gazoasă numit abur. Moleculele sub formă de vapori care ies evaporarea unui lichid sau solid.
fluid Nalem în vas și strâns strâns capacul său. După ceva timp, cantitatea de lichid este redusă din cauza evaporării sale. Molecule lăsând lichidul se va concentra pe suprafața sa sub formă de abur. Dar când densitatea vaporilor va fi relativ mare, unele dintre ele se va întoarce într-un lichid din nou. Iar aceste molecule vor fi mai mult și mai mult. În cele din urmă, va exista un moment în care numărul de molecule, care ies din lichid, iar numărul de molecule care se întorc la ea, va fi egal. În acest caz, se spune că fluidul este într-un echilibru dinamic cu vaporii săi. Un așa numit abur saturat.
Dacă vaporizarea lichidului se îndepărtează mai multe molecule decât se întoarce, o astfel de vapori va fi nesaturat. vapori de nesaturata este generat atunci când lichidul se evaporă într-un vas deschis. Lăsând moleculele sale dispersate în spațiu. Revenit la lichid, nu toate dintre ele.
condensarea aburului

transfer invers al unei substanțe din stare gazoasa in stare lichida se numește condensare. Când condensarea parte din moleculele de vapori înapoi într-un lichid.
Vaporii începe să se transforme în fluid (condensează) cu o anumită combinație de temperatură și presiune. Această combinație se numește punctul critic. Temperatura maximă sub care începe condensarea se numește kriticheskoytemperaturoy. La temperaturi de peste gazul critic nu se transformă într-un lichid.
La punctul critic de stări de fază ale interfeței lichid-vapori erodat. Dispare tensiune superficială lichid, densitatea fluidului egalizată și vapori de saturație.
Când echilibrul dinamic, atunci când numărul de molecule care părăsesc lichidul și revenirea l la fel, procesele de evaporare și condensare sunt echilibrate.
După evaporarea moleculelor de apă sub formă de vapori de apă. care este amestecat cu aer sau alt gaz. Temperatura la care vaporii din aer devine saturat, începe să se condenseze pe răcire și se transformă în picături de apă, numit punct de rouă.
Când aerul este o cantitate mare de vapori, a declarat că conținutul său de umiditate este crescută.
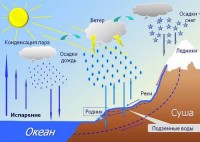
În natura, evaporare si condensare vom vedea foarte des. Dimineața de ceață, nori, ploaie - toate acestea sunt rezultatul acestor fenomene. Deoarece suprafața pământului în timp ce încălzirea evaporează umezeala. Moleculele vaporii rezultați în creștere în sus. Întâlnire pe frunzele lor un fel sau iarba rece, abur condensează pe ele sub formă de picături de rouă. Puțin mai mare în straturile de suprafață, devine o ceață. O mare înălțime în atmosferă, la o temperatură scăzută a aburului răcit este transformată în nor, constând din picături de apă sau de cristale de gheață. Ulterior, acești nori la sol ploaia veni în jos sau să cadă grindină.
Cu toate acestea, picăturile de apă formate prin condensarea numai în cazul când aerul sunt particule solide sau lichide minut, care sunt numite nuclee de condensare. Acestea pot fi produse de ardere, prin pulverizare, particule de praf deasupra particulelor de sare de ocean mare, formate ca urmare a reacțiilor chimice în atmosferă și altele.
sublimare

Uneori, materialul poate trece din starea gazoasă direct în substanța solidă, fără a trece printr-o fază lichidă. Acest proces este numit sublimare.
modele de gheață care apar pe ochelarii în frig, și există un exemplu. sublimare Atunci când solul este acoperit cu brumă îngheț - cristale de gheață fine, care sa transformat în vapori de apă din aer.