Principalele prevederi ale ILC - studopediya
Teoria cinetică moleculară numită teorie a structurii și proprietăților substanțelor bazate pe reprezentarea existenței atomilor și moleculelor ca cele mai mici particule de produs chimic.
Baza teoriei moleculare-cinetică se bazează pe trei puncte principale:
1. Toate substanțele - lichide, solide și gazoase - sunt formate din particule minuscule - molecule care sunt ele însele compuse din atomi ( „molecule elementare“). Moleculele chimice pot fi simple sau complexe și constau dintr-unul sau mai mulți atomi. Molecule și atomii sunt particule neutre electric. În anumite condiții, moleculele și atomii pot dobândi sarcină electrică suplimentară și să se transforme într-un ioni pozitivi sau negativi.
2. Atomii și moleculele sunt în mișcare aleatoare constantă.
3. Particulele interacționează unele cu celelalte forțe având în natură electrică. interacțiunea gravitaționale dintre particule este neglijabilă.
Figura 3.1.1. Traiectoria particulelor browniene.
Confirmarea experimentală cea mai izbitoare a reprezentărilor teoriei moleculare-cinetică a mișcării aleatoare a atomilor și moleculelor este mișcarea browniană. Această mișcare termică a particulelor microscopice mici suspendate într-un lichid sau gaz. Acesta a fost descoperit de către botanistul englez R. Brown (1827). Particulele browniene deplasa sub influența unor șocuri molecule dezordonate. Din cauza mișcării termice aleatoare a moleculelor, aceste greve nu se vor anula reciproc. Ca rezultat, viteza particulelor browniene variază în mod aleatoriu în magnitudine și direcție, iar traiectoria este o curbă zigzag complexă (Fig. 3.1.1). Teoria mișcării browniene a fost creat de Albert Einstein (1905). Teoria lui Einstein a Experimental fost confirmată în experimente de fizicianul francez Jean Perrin (1908-1911 gg.).
Forțele dintre două molecule, în funcție de distanța dintre ele. Moleculele sunt structuri spațiale complexe care conțin taxe atât pozitive, cât și negative. În cazul în care distanța dintre molecule este suficient de mare, apoi dominat de forțele de atracție intermoleculară. La distanțe mici forțe repulsive prevalează. În funcție de forța F rezultată și interacțiunea potențială Ep a energiei între moleculele distanța dintre centrele lor este prezentată calitativ în Fig. 3.1.2. La o distanță r = r0 forța de interacțiune dispare. Această distanță poate fi luată în mod convențional ca diametrul moleculei. Energia potențială interacțiune atunci când r = r0 minimă. Pentru a elimina din fiecare alte două molecule la o r0 distanta. trebuie să-i informeze E0 un plus de energie. Cantitatea E0 este adâncimea potențialului bine sau energia de legare.
Figura 3.1.2. Forța de interacțiune F și energia potențială de interacțiune între două molecule Ep. F> 0 - o forță de respingere, F <0 – сила притяжения.
Molecule sunt extrem de mici în dimensiune. Moleculele monohidroxilici simple au o dimensiune de ordinul a 10 -10 m. Moleculele poliatomice complexe pot avea dimensiuni de sute sau mii de ori mai mare.
mișcarea haotică dezordonată a moleculelor se numește mișcare termică. Energia cinetică a mișcării termice crește odată cu creșterea temperaturii. La temperaturi scăzute, energia cinetică medie a moleculei poate fi mai mică decât adâncimea potențialului E0 bine. In acest caz, moleculele condensează în stare lichidă sau solidă; în care distanța medie dintre molecule este aproximativ egal cu r0. Cu creșterea temperaturii, energia cinetică medie a moleculelor este mai mare decât E0. zbura moleculă, și a produs substanță gazoasă.
In solide, moleculele efectua fluctuații aleatorii în jurul punctelor fixe (puncte de echilibru). Aceste centre pot fi aranjate într-un mod neregulat în spațiul (corpul amorf) sau structuri în vrac sub formă ordonată (solide cristaline) (vezi. §3.6).
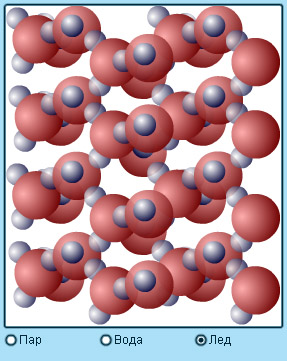
Modelul. Statele agregate.
În lichide, moleculele au o libertate mult mai mare pentru mișcarea termică. Ele nu sunt legate de centre specifice și se pot deplasa în întregul volum al lichidului. Acest lucru explică fluxul de lichide. Molecula de lichid strâns distanțate pot forma structuri ordonate care conțin mai multe molecule. Aceasta se numește ordine cu rază scurtă, în contrast cu ordinea de rază lungă de acțiune. caracteristic solidelor cristaline.
Distanța dintre moleculele de gaz este de obicei mult mai mare decât dimensiunea lor. Forțele de interacțiune dintre moleculele la asemenea distanțe mari este mică, iar fiecare moleculă se deplasează de-a lungul unei linii drepte, până la următoarea coliziune cu o altă moleculă sau cu peretele vasului. Distanța medie dintre moleculele de aer, în condiții normale de ordinul a 10 -8 m, m. E. Zeci de ori mărimea moleculelor. Interacțiunea slabă între moleculele explică capacitatea de gaze pentru a extinde și umple întregul volum al vasului. În limita când interacțiunea tinde la zero, ajungem la conceptul unui gaz ideal.
În teoria moleculară cinetică a cantității de substanță este considerată a fi proporțională cu numărul de particule. cantități unitare de substanțe numite mol (mol).
Mol - o cantitate dintr-o substanță care conține aceeași cantitate de particule (molecule), așa cum există atomi în carbon-12 0,012 kg de carbon C. Molecula constă dintr-un singur atom.
Astfel, un mol de orice substanță conține același număr de particule (molecule). Acest număr se numește constanta AvogadroNA:
Această ecuație stabilește relația dintre presiunea p gaz ideal, m0 masa a moleculei. concentrația de n molecule. valoarea medie a vitezei la pătrat și energia cinetică medie a mișcării de translație a moleculelor. Aceasta se numește ecuația fundamentală a teoriei cinetice moleculare a gazelor.
Astfel, presiunea gazului este egală cu două treimi din energia cinetică medie a mișcării de translație a moleculelor conținute în unitatea de volum.
Ecuația fundamentală a teoriei cinetice moleculare a gazelor conține o concentrație de produs de n molecule din energia cinetică medie a mișcării de translație. Presupunând că gazul stocat în vasul constant V. volumul (N - numărul de molecule din vas). În acest caz, modificarea presiunii # 916; p este proporțională cu variația energiei cinetice medii.
Întrebările apar: cum să schimbe experiența energiei cinetică medie a mișcării de molecule într-un vas de volum constant? Ce cantitate fizică care urmează să fie schimbat pentru a schimba energia cinetică medie în fizică Această valoare este temperatura.
Conceptul de temperatură este strâns legată de conceptul de echilibru termic. Corpurile sunt în contact unele cu altele, pot partaja energie. Energia transferat într-un alt corp cu contact termic, numita cantitate de căldură.
echilibru termic - este un sistem de stat de organisme care sunt în contact termic, în care nu există nici un transfer de căldură de la un corp la altul, și toți parametrii macroscopice ale organismelor rămân neschimbate. Temperatura - este un parametru fizic, care este aceeași pentru toate corpurile sunt în echilibru termic. Posibilitatea introducerii conceptului de temperatură trebuie să fie din experiență, și se numește legea zero a termodinamicii.
Pentru a măsura temperatura folosind instrumente fizice - termometre. în care o valoare a temperaturii este evaluată prin schimbarea unei proprietăți fizice. Pentru a crea un termometru trebuie să selecteze substanța termometrică (de exemplu, mercur, alcool) și valoarea thermometric. caracterizând proprietatea unei substanțe (de exemplu, lungimea coloanei de mercur sau alcool). In diverse constructii termometre folosesc o varietate de proprietăți fizice ale substanței (de exemplu, modificări ale dimensiunilor liniare ale solidelor sau schimbare în rezistența electrică a conductorilor prin încălzire).
Termometre ar trebui să fie calibrate. În acest scop, ele sunt aduse în contact termic cu organismele care respectiva temperatură predeterminată. Cele mai frecvent utilizate sisteme naturale simple, în care temperatura rămâne constantă, în ciuda schimbului de căldură cu mediul - un amestec de gheață și apă și amestec de apă și abur prin fierbere la presiune atmosferică. Prin Celsius scala temperatura gheții topire este atribuită temperatura de 0 ° C și punctul de fierbere al apei - 100 ° C. Modificarea lungimii coloanei de lichid din termometru capilar o sutime din lungimea între marcajele 0 ° C și C este luat egal cu 100 ° până la 1 ° C În unele țări (SUA) este utilizat pe scară largă Fahrenheit (TF), în care temperatura de congelare a apei este luată egală cu 32 ° F, iar punctul de fierbere al apei egal cu 212 ° F. Prin urmare,
Locul special in fizica ocupa termometru cu gaz (Figura 3.2.4.), În care substanța termometrică este gazul rarefiată (heliu, aer) într-un vas de volum constant (V = const), o cantitate termometrică - presiunea gazului p. Experiența arată că presiunea gazului (la V = const) crește odată cu creșterea temperaturii, măsurate pe scara Celsius.
Figura 3.2.4. termometru cu gaz cu volum constant.
Pentru calibrarea volumului constant termometru cu gaz, presiunea poate fi măsurată la două valori ale temperaturii (de exemplu, 0 ° C și 100 ° C), a pus P0 punct și P100 pe grafic, apoi trage o linie dreaptă (Fig. 3.2.5) între ele. Folosind curba de calibrare astfel preparată, se poate determina temperatura corespunzătoare celorlalte valori de presiune. Extrapolând din graficul la presiuni mai mici, este posibil să se determine o anumită temperatură „ipotetic“, la care presiunea gazului va fi zero. Experiența a demonstrat că această temperatură este -273,15 ° C și depinde de proprietățile gazului. Incapabil experimental obținut prin răcirea gazului într-o stare de presiune zero, deoarece la temperaturi foarte scăzute, toate gazele trec în stare lichidă sau solidă.
Figura 3.2.5. dependența de presiune a gazului asupra temperaturii la V = const.
fizicianul englez William Kelvin (Thomson) în 1848 a propus utilizarea unui punct de presiune a gazului zero pentru construirea unei noi scale de temperatură (scara Kelvin). La această scară, unitatea de măsurare a temperaturii este aceeași ca și în scara Celsius, dar punctul zero este deplasată:
Unitatea SI de măsură acceptate Kelvin Kelvin apel temperatură notată cu litera K. De exemplu, temperatura camerei TA = 20 ° C Kelvin este egal cu TC = 293,15 K.
scala de temperatură Kelvin se numește scara absolută a temperaturii. Acesta este cel mai convenabil pentru construirea de teorii fizice.
Nu este nevoie de a lega scara Kelvin la două puncte fixe - punctul de topire a gheții și punctul de fierbere a apei la presiunea atmosferică, așa cum se obișnuiește în scara Celsius.
De asemenea, presiunea gazului de punctului zero, care se numește absolut temperatura zero. suficient pentru a lua un alt punct de referință fix. Scara Kelvin ca atare este utilizat în ceea ce privește temperatura apei a punctului triplu (0,01 ° C), în care toate cele trei faze sunt în echilibru termic - gheață, apă și abur. Temperatura Kelvin a punctului triplu se presupune a fi 273,16 K.
termometre de gaz sunt greoaie și incomod pentru utilizarea practică: acestea sunt folosite ca standard pentru calibrare de precizie a altor termometre.
Astfel, presiunea gazului rarefiate într-un vas de volum constant V este direct proporțională cu temperatura absolută: p
T. Pe de altă parte, experiența arată că la volum constant V și presiunea gazului T temperatura variază direct proporțional cu cantitatea de raport substanță # 957; în vasul la volumul V al vasului
unde N - numărul de molecule din vas, NA - numărul Avogadro, n = N / V - concentrația moleculară (de exemplu, numărul de molecule pe unitatea de volum al vasului ..). Combinând aceste relații de proporționalitate, putem scrie:
unde k - o constantă universală pentru toate gazele. Aceasta se numește constanta Boltzmann. în onoarea fizicianului austriac L. Boltzmann (1844-1906 gg.), unul dintre fondatorii teoriei moleculare-cinetice. constanta lui Boltzmann - una dintre constantele fizice fundamentale. Valoarea sa numerică în SI este:
k = 1,38 · 10 -23 J / K.
Comparând raportul p = nkT cu ecuația de bază teoria cinetică moleculară a gazelor, se pot prepara următorii compuși:
Energia cinetică medie a mișcării aleatoare a moleculelor de gaz este direct proporțională cu temperatura absolută.
Astfel, temperatura este o măsură a energiei cinetică medie a mișcării de translație a moleculelor.
Trebuie remarcat faptul că energia cinetică medie a mișcării de translație a unei molecule este independentă de masa sa. particulă browniană în suspensie în lichid sau gaz are aceeași energie cinetică medie ca moleculă separată a cărei masă este de mai multe ordine de mărime mai mică decât masa particulelor browniene. Această concluzie se aplică în cazul în care nava este chimic amestec neinteracțiune de gaze, din care moleculele au mase diferite. In starea de echilibru ale moleculelor gaze diferite vor avea o energie cinetică medie identică mișcării termice determinate numai de temperatura amestecului. amestec de gaz sub presiune în peretele vasului va consta din presiunile parțiale ale fiecărui gaz:
Acest raport n1. n2. n3. ... - concentrația moleculară a diferitelor gaze în amestec. Această relație este exprimată în limbajul teoriei moleculare cinetice stabilit experimental la începutul secolului XIX, legea lui Dalton: presiunea din amestecul de vedere chimic care nu interacționează cu gaz egală cu suma presiunilor parțiale.