Rata de reacție chimică
Rata de reacție chimică. Definiția.
Reacțiile chimice continua la rate diferite. De la bine-cunoscute până în prezent, cele mai rapide reacții are loc în 10 până la 40 de ori mai rapid decât cel mai lent. Transformarea grafitului în diamant în măruntaiele pământului - un răspuns foarte lent. Un amestec de oxigen cu hidrogen explozie se produce practic instantaneu.
Cum se compara ratele de reacții cantitativ?
Viteza - o schimbare într-o cantitate în timp.
H2 + I2 = 2HI
Încerca să determine viteza de reacție a cheltuielilor de reactivi pe unitatea de timp. De exemplu, ca aceasta:
v (H2) = m (H2) / D t, v (I2) = m (I2) / D t
în cazul în care v - rata de reacție, m - masa diminuat reactiv adecvat, D t - intervalul de timp.
Dar v (H2) nu este egal cu v (I2). Masele de hidrogen și iod reacționat în unitatea de timp nu este egal.
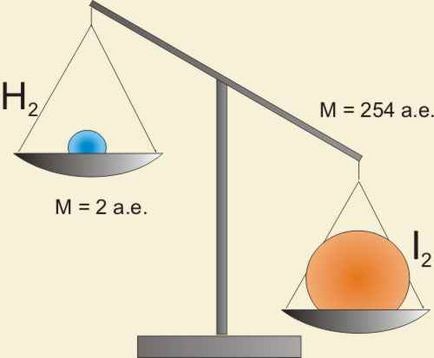
Reacția are loc într-un raport molar de 1: 1, dar nu și în masa! Să încercăm un mod diferit:
v (H2) = n (H2) / D t, v (I2) = n (I2) / D t
în loc de a lua cantitatea de masă de substanțe.
v (H2) = v (I2)
Dar, dacă în primul caz vom lua numărul de moli de scădere pe unitatea de timp în 1 ml de amestec, în timp ce al doilea - în 1 I dintr-un amestec, viteza va fi egală din nou! Acestea depind de volumul. Dacă vom trage aceeași reacție într-o eprubetă mică și într-un butoi mare, in vitro reacționează număr mai mic de substanțe - pur și simplu pentru că există mai puțin reactiv.
Și dacă rezultatul acestor expresii la unitatea de volum?
v (H2) = n (H2) / V D t = Dc (H2) / D t, v (I2) = n (I2) / V D t = Dc (I2) / D t
unde D c schimbarea concentrațiilor molare ale substanțelor respective.
Apoi, VH2 = VI2 = v această reacție!
Astfel, definiția finală va fi:
Viteza de reacție chimică - o modificare într-una din concentrația molară a reactanților pe unitatea de timp: