vapori de apă, un blog despre energie
stare intermediară a materiei între starea unui gaz reale și vapori de lichid numit sau doar abur. lichid vaporizat este o fază de tranziție de la o stare la alta. În tranziția de fază observată o schimbare bruscă a proprietăților fizice ale materiei.
Exemple de astfel de tranziții de fază este un proces de fierbere lichid cu introducerea de abur saturat umed și tranziția sa ulterioară lipsită de umiditate în procedeul uscat fierbere abur saturat sau invers de condensare a vaporilor.
Una dintre principalele proprietăți ale aburului saturat uscat este că alimentarea suplimentară de căldură pentru a conduce la o creștere a temperaturii aburului, adică tranziția către o stare de abur supraîncălzit, precum și eliminarea căldurii - .. O tranziție la starea de vapori umedă.
stări de fază de apă
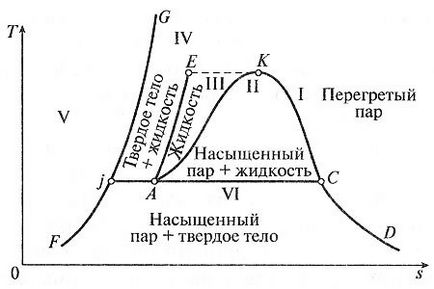
Figura 1. Diagrama de fază de vapori de apă în T, s coordonatele.
Oblasti - stare gazoasă (abur supraîncălzit având proprietățile unui gaz real);
OblastII - stare de echilibru de apă și abur saturat (stat în două faze). Zona II, de asemenea, numit regiunea vaporizarea;
OblastIII - stare lichidă (apă). Regiunea III este izotermei limitată CE;
OblastIV - starea de echilibru a fazelor lichide și solide;
Regiunea III, II și I sunt separate prin liniile de delimitare AK (linia din stânga) și KD (linia dreapta). Punct K Total pentru liniile de frontieră AK KD și are proprietăți speciale se numește punctul critic. Acest punct are parametri PKR, Vcr și Tcr. în care apa de fierbere trece în aburul supraîncălzit, care trece regiunea în două faze. În consecință, apa nu poate exista la temperaturi peste Tc.
Punctul critic K are parametrii:
Valorile p, t, v, și pentru ambele linii de delimitare sunt în tabele speciale ale proprietăților termodinamice ale vaporilor de apă.
Procesul de producere a aburului de apa
Figurile 2 și 3 prezintă procesul de încălzire a apei la fierbere, vaporizarea și supraîncălzit în p, v - și T, s-diagrama.
Starea inițială a apei lichide sub presiune p0 și având o temperatură de 0 ° C, este reprezentată în figurile p, v și T, s litera a. Când aport de căldură la p = const, temperatura crește și crește volumul specific. La un moment dat, temperatura apei ajunge la punctul de fierbere. În această stare este desemnat litera b. Cu continuare vaporizarea de căldură de intrare începe cu o creștere puternică a volumului. Acesta formează un mediu cu două faze - amestec de apă și abur, numit vapori saturați umed. Temperatura amestecului nu se schimbă, deoarece căldura consumată pentru vaporizarea fazei lichide. proces vaporizarea în acest stadiu este izobară-izoterma și este notat pe diagrama ca porțiune bc. Apoi, la un moment dat, toată apa este transformată în abur, denumit uscat saturat. Această stare este indicată în punctul diagrama c.
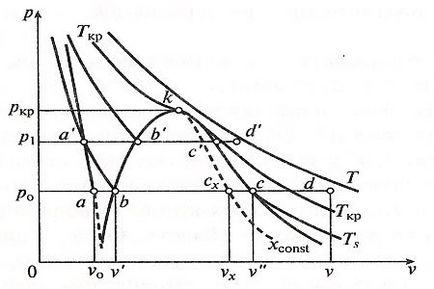
Figura 2. Diagrama p, v apă și abur.
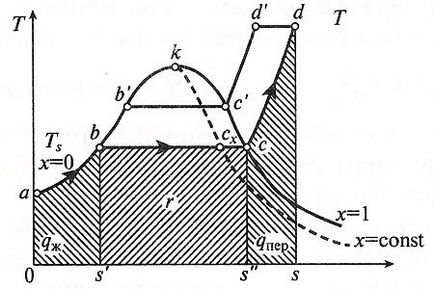
Figura 3. Diagrama T, s pentru apă și vapori de apă.
Cu aport de căldură suplimentară va crește temperatura aburului va curge supraîncălzit proces c - d. Punctul d este desemnat o stare de vapori supraîncălziți. Distanța de la punctul d la punctul depinde de temperatura aburului supraîncălzit.
Indexarea pentru a desemna cantitățile referitoare la diferitele stări de apă și abur:
- Valoarea cu subscriptului „0“ se referă la starea inițială a apei;
- valoare cu sufixul „„“se referă la apă, încălzită la temperatura (saturație) la fierbere;
- valoare cu sufixul „„“se referă la aburul saturat uscat;
- Valoarea indicelui «x» se referă la aburul saturat umed;
- valoare fără un indice se referă la abur supraîncălzit.
Procesul de vaporizarea la p1 presiune mai mare> p0 poate observa faptul că un punct care reprezintă starea inițială de apă la 0 ° C, iar noua presiune este aproape aceeași linie verticală, deoarece volumul specific de apă este aproape independentă de presiune.
Litera b „(starea de apă la temperatura de saturație) este deplasat spre dreapta prin p, v și -diagram se ridică la T, s -diagram. Acest lucru se datorează faptului că, cu o creștere a presiunii crește temperatura de saturație, și, prin urmare, un volum specific de apă.
Litera c „(starea de abur saturat uscat) deplasează spre stânga, adică. K. Presiunea crește volumul specific al vaporilor este redusă în ciuda creșterii temperaturii.
Compusul multitudine de puncte b și c, la presiuni diferite, oferă o mai mică și o curbe la limita superioară ak și kc. Din p, v-diagrama se poate observa că, diferența de presiune dintre volumul specific v „și descrește v“ și la o anumită presiune devine zero. În acest moment, numit curbele limită critice converg ak și kc. Stat care corespunde punctului k. Se numește critică. Acesta este caracterizat prin faptul că, atunci când acesta și volumele specifice de vapori de apă sunt identice sau diferite în proprietăți unul față de celălalt. Regiunea situată într-un triunghi BKC curbiliniu (în p, v -diagram), corespunde vaporilor saturați umed.
Starea de abur supraîncălzit portretizat puncte situate deasupra curbei superioare kc de delimitare.
La T, s corespunde 0abs zona -diagram la cantitatea de căldură necesară pentru încălzirea apei lichide la temperatura de saturație.
Numărul Rezumând de căldură, J / kg, egală cu căldura de vaporizare r, este exprimat de o zonă s'bcs și relația cu ea:
Cantitatea de căldură în timpul Rezumând aburului supraîncălzit reprezentat de zonă s „cds.
La T, s -diagram văzut că pe măsură ce presiunea scade și căldura de vaporizare, la punctul critic devine zero.
In mod normal, T, s folosit -diagram pentru studii teoretice, deoarece utilizarea practică este făcută foarte dificilă prin faptul că cantitatea de căldură exprimată în zonele de forme curbilinii.