08 - Prepararea soluțiilor și determinarea concentrației acestora (np)
Prepararea concentrației exacte soluție
(Titrat cu soluție standard).
Titrant este preparat în diferite moduri.
1. Dacă luăm o mostră exactă a substanței dorite (m, r) se transferă cantitativ într-un balon gradat (V ml), se dizolvă și se umple cu apă distilată până la marcajul, apoi închideți dopul și se amestecă, se obține concentrația dorită de soluție cu un titru cunoscut T =
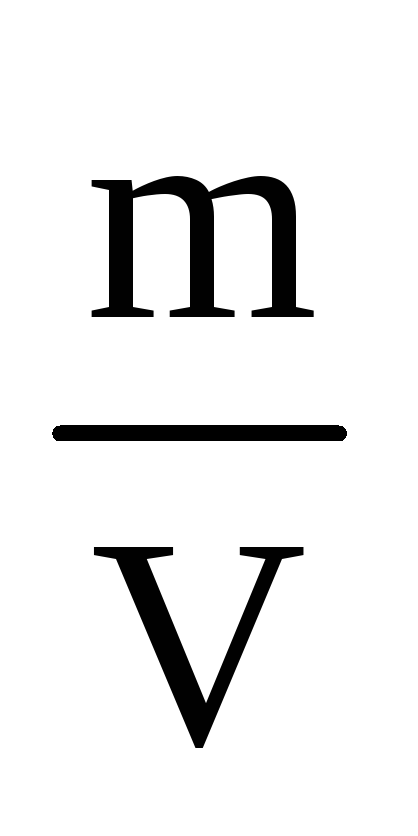
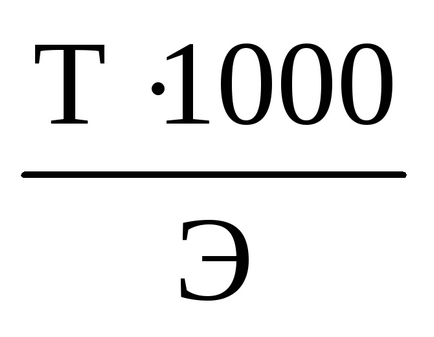
2. titrant este preparat, de asemenea, prin utilizarea „fiksanaly“ - standard de-titluri. Acestea sunt sigilate fiolă din sticlă conținând cantități cântărite cu precizie de diverse substanțe cristaline sau volume precis măsurate de titrant necesar pentru prepararea de 1 litru de soluție normalității exact cunoscută, de exemplu 0,1 N (cel mai des), 0,05 N, etc.
Deoarece flaconul este sigilat, atunci fiksanal pot fi stocate timp foarte lung, cu excepția bazelor care sunt depozitate devin rapid turbiditate datorită interacțiunii dintre fiole de sticlă alcaline. Aruncați soluțiile tulbure pentru a fi utilizate nu sunt adecvate.
Prepararea titrant titrului standard, este redus pentru a se transferă cantitativ conținutul fiolei într-un balon cotat cu capacitate de 1 litru, iar substanța apoi dizolvată și soluția rezultată a fost diluată la semn cu apă distilată.
Metodele standard de transfer al unui titru balon.
Pentru transferarea materialului în pâlnia volumetric cu trei gâturi de 1 litru introdus în ea împiedică percutor, pe care a stabilit fiksanala sticluță fund adâncitură subțire. ușor impact asupra fiolei percutor sparge geamul și ruperea trestiei ascuțit deschiderea superioară în flacon, substanța se transferă într-un balon gradat. Prin gaura se spală minuțios cu apă distilată conținutul fiolei, pâlnia și spălată prin îndepărtarea lui, volumul soluției se ajustează în vasul la semn cu apă distilată.
pâlnie de sticlă introdus un balon cotat. Pe de o parte fiola prin PIN-ul perforator. flacon Provernuv, complet gratuit de conținutul și spălat bine cu apă distilată, din interior, în valoare de șase ori volumul fiolei. Se dizolvă conținutul flaconului în balon, se aduce volumul de lichid la semn și se amestecă bine.
ATENȚIE. Ampule pâlnie titrului standard un percutor de sticlă trebuie să fie spălate bine cu apă, cu o etichetă fiolă trebuie îndepărtată.
Mod de preparare cu soluție
Prepararea o concentrație predeterminată a soluției concentrate prin diluare cu apă, folosind un hidrometru (densimetru)
Densitatea pre-determinată a soluției concentrate cu un hidrometru.
Hidrometru este un vas închis termic gol cu aplicat pe ea etichete (de obicei atașate la interior gradațiile scara perete de hârtie). In partea de jos a mărfurilor plasate (fracție), prin care hidrometru cufundați în lichidul, sprijinit într-o poziție verticală.
Soluția concentrată a fost turnată în cilindru, astfel încât acesta nu a avut loc prin transfuzii de sânge prin regiunea imersiune areometrului și hidrometru să nu atingă fundul cilindrului. Hidrometru trebuie să fie curate și uscate. În timpul hidrometrul de referință nu trebuie să se rotească și atingă pereții cilindrului. Pe o scală de citiri hidrometrice spune cu o anumită precizie. Divizarea scalei, care coincide cu nivelul lichidului arată densitatea soluției. Ridicarea hidrometru 1-2 cm, din nou în soluția de întâlnire și încă o dată citiri.
Atunci când se utilizează un hidrometru trebuie amintit faptul că temperatura soluției trebuie să corespundă la o temperatură la care este calibrat.
Se determină densitatea soluției concentrate, conform tabelului „fracțiunea de masă și densitatea soluției“ găsită fracția masică de substanță în soluție și apoi se efectuează calculul. Se determină volumul soluției concentrate, care trebuie luate pentru a prepara o soluție cu o concentrație predeterminată și un volum predeterminat.
În absența valorii densității Tabelul găsite folosind un hidrometru, fracția corespunzătoare masei de substanță (concentrație procentuală) a fost determinată prin interpolare - valoare intermediară la determinarea două extreme. Pentru a face acest lucru, efectuați următoarele calcule.
De exemplu, la o soluție de densitate KNO3 0.0183 absentă, dar există și alte valori 1.076 și 1.090. Ele corespund unei concentrații de 12% și 14%.
Găsiți o diferență de densitate și a concentrațiilor:
Numărul obținut se adaugă la valoarea mai mică luată din tabelul concentrației de 12 + 1 = 13% - este concentrația soluției de testat.
Prepararea soluției de solid cristalin și apă.
Să presupunem că este necesar pentru a prepara 250 ml de soluție 0,1 N NaOH (Mae = 40 g / mol). Deoarece metal alcalin, hidroxizi carbonați conțin impurități, umiditate, și alte substanțe, pentru a prepara o soluție predeterminată cu precizie concentrația de alcaline cristaline și a apei este imposibilă. De aceea prepara soluția brută (cu o concentrație apropiată de obiectivul) și clarifica soluția de titrare concentrație cu concentrație cunoscută exact.
Metode de preparare a soluției
Se calculează eșantionul de dorit alcalin pentru gătit soluție predeterminată: m = N · V · Mae = 0,1 · 0,25 · 40 = 1 g
Se cântărește cantitatea calculată de alcalii în echilibru technochemical cu o precizie de 0,01 g de ponderare se face în hârtie de filtru de porțelan ceașcă sau sticlă cu grijă spălate și uscate, a căror masă este predeterminată.
Alcali selectat spatula sau o pensetă din plastic.
Produsul obținut cântărește într-un balon Erlenmeyer, măsurați cilindru cantitatea necesară de apă (volum soluție pentru apă brută poate fi luată egală cu volumul de soluție) se clătește în mod repetat porțelan (sticlă) ceașcă și se toarnă apă în vasul cu alcalii. Dizolvarea sârmă alcalină mai întâi într-o cantitate mică de apă, sub agitare puternică, cel puțin dizolvarea alcalină se adaugă următoarele porțiuni de apă. După procedura, soluția trebuie să fie bine amestecat.
Determinarea concentrației exactă a soluției de titrare alcalină cu HCI
Pure clătire biureta cantitate mică de soluție alcalină preparată. Întărirea clemă biuretă în suport și umple-l printr-o pâlnie cu o soluție de NaOH (sau KOH) la zero (la partea de jos a limitei meniscului). Asigurați-vă că vârful biuretă a fost umplut cu soluții. Pune pe un trepied stativ foaie albă. Aspirati pipetată într-un balon cu blândețe conic, 10 ml de acid clorhidric titrant, se adaugă 1-2 picături de indicator fenolftaleină și titrați. Se adaugă soluția alcalină în porțiuni mici, în timp ce soluția a fost se amestecă într-o mișcare circulară într-un balon conic. După neutralizarea tot acidul care curge din ecuația:
HCl + NaOH = NaCl + H2O
adăugând o picătură în plus de soluție alcalină va determina apariția de culoare roz. Titrarea este considerată completă atunci când culoarea roz a soluției dispare în balon cu agitare, timp de 30 de secunde. Count volum biureta de bază necesare pentru a neutraliza acidul. Titrarea petrec cel puțin trei ori. de fiecare dată de la zero. Volumele de leșie cheltuite nu ar trebui să difere cu mai mult de 0,1-0,2 ml. Din aceste rezultate, să ia valoarea medie și se calculează concentrația exactă a alcalii prin formula:
Activitatea de laborator
Se prepară fiksanala de HCI 0,1N - Soluție etalon.
Se prepară o soluție de NaOH (sau KOH), cu o concentrație aproximativă în balon cu fund plat la o sarcină individuală.
Se determină densitatea soluției alcaline areometrului, și se calculează concentrația sa normală.
Set soluție de concentrație exactă de titrare alcalină cu soluție standard de acid clorhidric.
Comparați rezultatele obținute în revendicări. 3 și 4.
Aranjarea registru de laborator, care rezultă în calculele pentru fiecare secțiune și o scurtă descriere a operațiunilor.