fizica moleculara
abur saturat.
La evaporarea simultan cu trecerea moleculelor de lichid la vapori are loc procesul invers. Aleatoriu se deplasează deasupra suprafeței lichidului, a moleculelor, la stânga se întoarce din nou la un lichid.
Dacă evaporarea are loc într-un vas închis, mai întâi numărul de molecule de lichid emis va fi mai mare decât numărul de molecule, se întoarce înapoi la un lichid. Prin urmare, densitatea vaporilor în vasul va crește treptat. Odată cu creșterea crește densitatea vaporilor și numărul de molecule, revenind la lichidul. Numărul destul de repede de molecule, care ies din lichid, devine egal cu numărul de molecule de abur, se întoarce înapoi la un lichid. De atunci, numărul de molecule de vapori deasupra lichidului va fi constantă. Pentru apa la temperatura camerei, este aproximativ egal cu numărul de molecule pe 22 octombrie 1 per 1 cm2 suprafață. Vine echilibrul dinamic așa-numitul între vapori și lichid.
Steam, care este în echilibru dinamic cu lichidul său se numește abur saturat.
Aceasta înseamnă că, într-un volum dat, la o anumită temperatură poate să nu fie mai mare de vapori.
În echilibrul dinamic al masei de lichid nu este schimbat într-un vas închis, deși lichidul continuă să se evapore. În mod similar, nici o modificare și masa vaporilor saturați acestui lichid, deși vaporii continuă să se condenseze.
Saturate presiunea vaporilor.
În timpul compresiei aburului saturat, a cărui temperatură este menținută constantă, echilibrul este perturbat prima pornire: crește densitatea vaporilor, și astfel din gazul în lichidul va trece mai multe molecule decât de la lichid la gaz; Acest lucru va continua atâta timp cât concentrația de vapori într-un nou ecran nu va fi la fel, concentrația de vapori saturați care corespunde la o temperatură dată (și echilibrul este restabilit). Motivul este că numărul de molecule care părăsesc lichid pe unitate de timp, depinde numai de temperatura.
Astfel, concentrația moleculelor de vapori saturați la o temperatură constantă independent de volumul său.
Deoarece presiunea gazului este proporțională cu concentrația moleculelor sale, iar presiunea de vapori saturați este independentă de volumul său. P0 de presiune. în care lichidul este în echilibru cu vaporii săi se numește presiune de vapori.
Când compresia vaporilor cea mai mare parte merge într-o stare lichidă. Fluidul ocupă un volum mai mic decât aceeași masă a aburului. Volumul de abur la o constantă densitatea sa scade.
Dependența presiunii vaporilor de temperatură.
Pentru un gaz ideal este dependență liniară valabilă de presiune asupra temperaturii la volum constant. În ceea ce privește P0 saturate la presiunea vaporilor cu această dependență este exprimată de ecuația:
Deoarece presiunea de vapori saturați este independentă de volum, prin urmare, aceasta depinde numai de temperatura.
dependența determinată experimental de p0 (T) diferă în funcție de (p0 = nkT) pentru un gaz ideal.
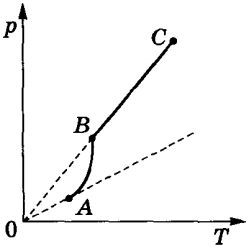
Cu creșterea temperaturii, presiunea vaporilor saturați crește mai repede decât presiunea unui gaz ideal (segmentul AB al curbei în figură). Acest lucru devine clar mai ales dacă vom trage isochor prin punctul A (linia punctată). Acest lucru se întâmplă pentru că atunci când este încălzit partea lichidă este transformată în abur și crește densitatea vaporilor. Prin urmare, în conformitate cu formula (p0 = nkT), saturate crește presiunea aburului, nu numai prin creșterea temperaturii fluidului, dar și datorită concentrației crescute de molecule (densitate) pereche. Principala diferență în comportamentul unui gaz ideal și aburul saturat este de a schimba masa aburului atunci când temperatura se modifică la un volum constant (cupă închisă) sau când schimbarea în volum la o temperatură constantă. Cu un nimic gaz ideal ca acest lucru nu poate avea loc (teoria moleculară cinetică a unui gaz ideal nu prevede tranziția de fază de gaz la lichid).
După evaporarea tuturor comportamentului vaporilichid va corespunde comportamentului unui gaz ideal (porțiunea BC a curbei din figura de mai sus).
abur Nesaturați.
Dacă, poate avea loc în spațiul care conține o pereche de lichid evaporarea ulterioară a lichidului, aburul fiind în acest spațiu este nesaturat.
Aburul care nu este în echilibru cu lichidul său, numit nesaturat.
abur Nesaturați poate stoarce doar transformat într-un lichid. Odată ce conversia este pornit, vaporii în echilibru cu lichidul devine saturat.