Hidrogen - un
HIDROGEN
H (lat. Hydrogenium),
Cel mai simplu element chimic gazos - un membru al subgrupei IA a sistemului periodic al elementelor, denumite uneori un subgrup VIIA. Atmosfera Pământului a hidrogenului în stare nelegată, există doar o fracțiune de minut, cantitatea de 1-2 părți per 1 500 000 părți de aer. De obicei el stă cu alte gaze în erupții vulcanice, din puțuri de petrol și descompunerea unor cantități mari de materie organica. Hidrogenul se combină cu carbon și (sau) de oxigen într-un organic carbohidrați de tip substanță, hidrocarburi, grăsimi și proteine animale. Hidrosfera hidrogen inclus în apă - compusul cel mai abundent din lume. În roci, soluri, solurile, și alte părți ale hidrogenului crustă se combină cu oxigenul pentru a forma apa si ioni de hidroxid OH-. Hidrogenul este de 16% din cantitatea crustei atomi, dar numai aproximativ 1% în greutate, deoarece este de 16 ori mai ușoară decât oxigenul. Masa Soarelui și stelele pe 70% constă din plasmă de hidrogen: în spațiul este elementul cel mai abundent. Concentrația de hidrogen în atmosferă crește odată cu altitudinea datorită densității reduse și capacitatea de a urca la altitudini mari. S-au găsit pe meteoriti suprafața Terrei conțin 6-10 atomi de hidrogen la 100 atomi de siliciu.
Informații istorice. Un alt medic german și om de știință Paracelsus în secolul al 16-lea. Hidrogen set inflamabilitate. In 1700 N.Lemeri constatat că gazele emise de acțiunea acidului sulfuric asupra fierului, explodează în aer. Element de hidrogen G.Kavendish identificat în 1766 și la numit „aer combustibil“, iar in 1781 a arătat că apa - este produsul reacției sale cu oxigen. hydrogenium latină, care provine din combinația grecească „apă gendereth“, Lavoisier a fost dat acest element.
Caracteristicile generale ale hidrogenului. Hidrogenul - un prim element din tabelul periodic; atom este compus dintr-un proton și rotirea în jurul unui singur electron
(A se vedea. De asemenea, Tabelul periodic).
Unul din 5000 este caracterizat prin având atomi de hidrogen în nucleul unei neutroni crește masa nucleului cu 1 la 2. Acesta este numit de izotopi de hidrogen deuteriu 21h sau 21D. O alta, izotop mai puțin comun al hidrogenului cuprinde doi neutroni în nucleu și se numește 31H tritiu sau 31T. Tritiul dezintegrează la radioactive și eliberarea de heliu și electroni. Miezuri de diferite izotopi de hidrogen difera rotiri de protoni. Hidrogenul poate fi obținută prin: a) acțiunea metalului activ în apă, b) acțiunea acizilor asupra anumitor metale, c) acțiunea bazelor de pe siliciu și unele metale amfotere, g) acțiunea aburului supraîncălzit la cărbune și metan, precum și fier, d) descompunerea electrolitică apă și descompunerea termică a hidrocarburilor. hidrogen chimic Activitatea este determinată de capacitatea sa de a dona electroni la un alt atom sau socializezi sa aproape în mod egal celorlalte elemente în formarea unei legături chimice sau atașați un alt electron element dintr-un compus chimic numit hidrură. Hidrogenul este produs comercial în cantități mari pentru a consuma sinteza amoniacului, acid azotic, hidruri metalice. Industria alimentară utilizează hidrogen pentru hidrogenare (hidrogenate) uleiuri lichide în grăsimi solide (de exemplu, margarina). uleiuri organice Hydrogenation saturate conținând legături duble între atomii de carbon sunt transformate în cele saturate având legături simple carbon-carbon. Puritatea ridicată (99.9998%), hidrogen lichid este utilizat în rachete spațiale ca foarte inflamabile.
Proprietăți fizice. Lichefierea și solidificarea hidrogenului necesită temperaturi foarte scăzute și presiune ridicată (vezi. Proprietățile tabelul I). În condiții normale, de hidrogen - gaz incolor, inodor și fără gust, foarte ușor: 1 litru de hidrogen la temperatura de 0 ° C și presiune atmosferică are o greutate de 0.08987 g (densitate cf. aerului și heliu 1.2929 și 0.1785 g / l. cu toate acestea balon umplut cu heliu și având același ascensor ca un balon cu hidrogen, ar trebui să fie mai mare volum de 8%). Tabelul I prezintă unele dintre proprietățile fizice și termodinamice ale hidrogenului. PROPRIETATI hidrogen obișnuit
(La 273,16 K sau 0 ° C)
Număr atomic 1 11H masă atomică 1.00797 Densitate, g / L
0.08987 sub presiune normală la 2,5 x 10 5 atm 0.66 2.7 * 1.12 atm 18 octombrie * 10 iulie
Raza covalentă a 0,74 Temperatura de topire, ° C -259.14 Punct de fierbere, ° C -252.5 Temperatura critică, ° C -239,92 (33,24 K) Presiune critică, atm 12,8 (12.80 K) specific J Heat / (molChK) 28,8 (H2) Solubilitate
în apă v / 100 volume H2O (în condiții standard) benzen în 2,148 ml / g (35,2 ° C, 150,2 bar) 11,77 amoniac, ml / g (25 ° C) sub 50 atm 4 47 la 1000 atm 79.25
Oxidarea -1, +1
Structura atomului. hidrogen neutru (protiu) este format din două particule fundamentale (electroni și protoni) și are o greutate atomică 1. Datorită mișcării de mare viteză a electronilor (2,25 km / s sau 1015 * 7 vol. / S) și corpusculare sale dualistică natura val este imposibil să se stabilească cu precizie coordonatele (pozitie) ale electronului la un moment dat în timp, dar există unele zone ale probabilitate ridicată de a găsi un electron, iar ele determină mărimea unui atom. Cele mai multe dintre proprietățile chimice și fizice ale hidrogenului, în special cele care aparțin de excitație (energia de absorbție) matematic prezis cu exactitate (a se vedea. Spectroscopy). Hidrogenul este similar cu metalele alcaline în faptul că toate aceste elemente sunt capabile să doneze un atom acceptor de electroni pentru a forma o legătură chimică, care poate varia de la (transfer de electroni), parțial ion la legarea covalentă (pereche de electroni total). Cu puternic acceptor de hidrogen de electroni formează un ion pozitiv H +, adică protoni. In electron orbita atomul de hidrogen poate fi de 2 electroni, cu toate acestea, hidrogenul este capabil de a accepta un electron pentru a forma un H- ion negativ, ion hidrură, și hidrogen este în comun cu halogen, care se caracterizează prin adoptarea unui electron pentru a forma un tip negativ halogenură Cl- ion. Dualismul hidrogen se reflectă în faptul că, în tabelul periodic al elementelor aranjate în subgrupele IA (metale alcaline) sale și, uneori, - (. vezi și chimie) un subgrup VIIA (halogeni).
Proprietăți chimice. Proprietățile chimice ale hidrogenului determinat de un singur electron. Cantitatea de energie necesară pentru separarea electronului, mai mult poate da orice oxidant chimic cunoscut. Prin urmare, legături de hidrogen chimic cu alți atomi este mai aproape de covalenta decât ionică. legătură covalentă Clean apare în formarea de molecule de hidrogen: H + H H2
În formarea unui mol (adică 2 grame) H2 eliberat 434 kJ. Chiar și la 3000 grade K de disociere de hidrogen este foarte mică și egală cu 9,03%, la 5000 K atinge 94% și numai la 10000 K disociere devine plin. În formarea a două moli (36 g) de apă din hidrogen atomic și oxigen (4H + O2 -> 2H2O) alocat mai mult de 1250 kJ și temperatura ajunge la 3000-4000 ° C, în timp ce arderea hidrogenului molecular (2H2 + O2 -> 2H2O) eliberat numai 285.8 kJ și temperatura de flacără atinge numai 2500 ° C, la temperatura camerei, hidrogen mai puțin reactiv. Pentru inițierea majoritatea reacțiilor necesare pentru a rupe sau slăbi puternică legătură H-H, după ce a petrecut o mulțime de energie. Reacțiile de hidrogen crește odată cu utilizarea catalizatorului (metale din grupa platinei, oxizi ai metalelor de tranziție sau grele) molecule și metode de excitație (lumină, descărcare electrică, cu arc electric, temperaturi ridicate). În aceste condiții, hidrogenul reacționează cu aproape orice element decat pentru gaze nobile. Elementele alcaline și alcalino-pământoase active (de exemplu, litiu și calciu) reacționează cu hidrogen, ca donor de electroni și care formează compus numit hidruri sare (2Li + H2 -> 2LiH; Ca + H2 -> CaH2).
În general, hidruri sunt compuși care conțin hidrogen. O varietate largă de proprietăți ale unor astfel de compuși (în funcție de atomul legat de hidrogen), caracteristici de hidrogen explicat taxa exponat -1-1 practic. Acest lucru este evident în similaritățile și CaH2 Lih și tipul de săruri CaCl2 și NaCl. Se crede că încărcate negativ hidrurile de hidrogen (H-); ion este un agent reducător într-un mediu acid apos: 2H- H2 + 2e- + 2,25B. ion H este capabil să reducă protonului apei H + la hidrogen gazos: H- + H2O (r) H2 + OH-.
Compușii cu hidrogen bor - borani (borohidrurilor) - reprezintă o clasă neobișnuită de compuși numiți borani. Cel mai simplu reprezentant este BH3, existent numai în forma unui B2H6 diboran stabil. Compuși cu un număr mare de atomi de bor produse în moduri diferite. Este cunoscut, de exemplu, B4H10 tetraborane, B5H9 pentaborane B5H11 stabila si instabila pentaborane, B6H10 geksaboran, B10H14 decaboran. Diboranul pot fi obținute de la BCI3 și H2 prin intermediarul B2H5Cl, care la temperatura de 0 ° C până la disproportionates B2H6 și reacția dintre hidrură de litiu și aluminiu Lih sau LiAlH4 c BCI3. În hidrură de litiu și aluminiu (complex compus - hidrură de ser fiziologic) patru atomi de hidrogen formează legături covalente cu Al, dar există o legătură ionică cu Li + [[AlH4]] -. Un alt exemplu de hidrogen-ion este ion borohidrură, BH4-. Mai jos hidruri clasificarea aspră conform proprietăților lor, în conformitate cu poziția elementelor în tabelul periodic al elementelor. hidrurile metalelor tranziționale sau metal numite intermediari și adesea nu formează compuși stoichiometric, adică, raportul dintre hidrogen la atomii de metal nu este exprimată într-un număr întreg, cum ar fi hidrură de vanadiu, și hidrură de ThH3,1 VH0,6 toriu. metale din grupa platinei (Ru, Rh, Pd, Os, Ir și Pt) absorb activ hidrogen și servesc catalizatori eficienți pentru reacțiile de hidrogenare (de exemplu hidrogenarea uleiurilor lichide pentru a forma grăsimi, convertiri azot pentru sinteza amoniacului din CO metanol CH3OH). Hidruri Be, Mg, Al și subgrupe Cu, Zn, Ga - polar, instabil termic.
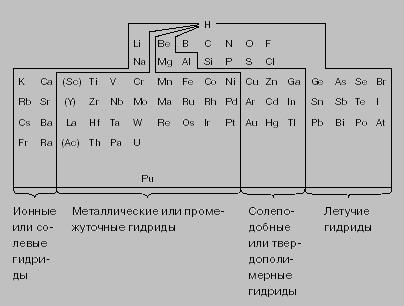
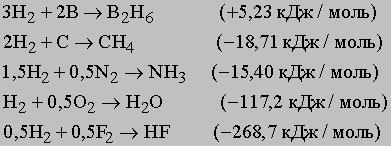
Metaloizi formează hidruri volatile cu formula MHX (x - este un număr întreg), cu un punct de fierbere relativ scăzut și presiune de vapori ridicată. Aceste hidruri diferă semnificativ de hidruri saline în care hidrogenul are o sarcină negativă. V hidruri volatile (de exemplu, hidrocarburi) este predominant legături covalente între hidrogen și nemetale. Deoarece amplificarea compus non-metalic caracter format parțial lipirea ionic, de exemplu H + Cl-, (H2) 2 + O2-, N3- (H3) 3+. Exemple specifice de formare a diferitelor hidruri enumerate mai jos (în paranteze căldură hidrură de formare):
4. Metoda de fier cu abur, prin care aburul la 500-1000 ° C este trecut peste fier: 3Fe + 4H2O Fe3O4 + 4H2 + 160,67 kJ. S-a obținut prin această metodă, hidrogenul este utilizat de obicei pentru hidrogenarea grăsimilor și uleiurilor. Compoziția de oxid de fier depinde de temperatura de proces; la nC + (n + 1) H2
6. Următorul volum al producției este metoda de metanol-abur: + H2O CH3OH -> 3H2 + CO2. Reacția este endotermă și se efectuează la VODOROD260 ° C în reactoare convenționale din oțel, la presiuni de până la 20 atm. 7. descompunere catalitică a amoniacului: 2NH3 -> LiOH + H2
(Această metodă este convenabilă pentru aplicarea directă a hidrogenului rezultat.) În reacția acizilor cu metale active și hidrogenul este eliberat, dar de obicei va fi contaminat de acid vapori sau alt gaz produs, de PH3 exemplu fosfine, H2S hidrogen sulfurat, arsina AsH3. Metalele cele mai active reacționează cu apa pentru a forma hidrogen și deplasează leșie: 2H2O + 2Na -> H2 + 2NaOH metodă de laborator distribuite pentru a obține H2 Kipp aparat de zinc reacționat cu acid clorhidric sau sulfuric:
Zn + 2HCl -> ZnCl2 + H2. hidrurile metalelor alcalino-pământoase (de exemplu, CaH2), hidruri complexe de sare (de exemplu, UAIH4 sau NaBH4) și niște borani (de exemplu, B2H6) prin reacție cu apă sau în timpul disocierea termică a hidrogenului este izolat. cărbune brun și abur la temperatură ridicată, de asemenea, interacționa cu evoluția hidrogenului.
de purificare de hidrogen. Gradul de puritate necesară de hidrogen este determinată prin aplicarea acestuia. Amestecarea dioxidului de carbon eliminat prin înghețare sau lichefiere (de exemplu, prin trecerea amestecului gazos printr-un azot lichid). Aceeași impuritate poate fi îndepărtat complet prin barbotarea prin apă. CO poate fi îndepărtată prin conversia catalitică a CO2 la CH4 sau sau lichefierea la tratament cu azot lichid. Adaosului de oxigen format în timpul electrolizei, apa este îndepărtată ca după evacuarea scânteie.
Utilizarea hidrogenului. Hidrogenul este utilizat în principal în industria chimică pentru producerea de acid clorhidric, amoniac, metanol și alți compuși organici. Este utilizat în hidrogenarea uleiurilor, și (pentru conversia combustibililor de grad scăzut în calitate înaltă) a cărbunelui și petrolului. Oțelul este redus prin utilizarea hidrogenului, unele metale neferoase din oxizii lor. Hidrogenul este utilizat pentru răcirea generatoarelor electrice de mare putere. Izotopii de hidrogen sunt utilizate în ingineria energiei nucleare. Flacăra de hidrogen-oxigen este utilizat pentru tăierea și sudarea metalelor.
REFERINȚE
Nekrasov BV Bazele chimiei generale. M. 1973 hidrogen lichid. M. 1980 Hidrogen în metale. M. 1981