producerea de aminoacizi
Dintre compușii produși prin metode biotehnologice, aminoacizi rang întâi în ceea ce privește producția și cea de a doua cea mai mare valoare din spatele ultimelor antibiotice parametru. Producția globală de aminoacizi este mai mult de 500 de mii. Tone pe an. Cu toate acestea, cantitatea menționată - doar o mică fracțiune din numărul dorit de aminoacizi. Potrivit OMS, umane au nevoie doar patru aminoacizi esențiali este, milioane de tone: lizină - 5, metionină - 4, treonină - 3,7 și triptofan - 2.
În scara industrială de proteine aminoacizi sunt:
· Hidroliza materiilor prime care conțin proteine naturale;
· Biotransformarea precursoare aminoacizilor folosind microorganisme sau enzime izolate din ele (metoda chimică și microbiologică).
Hidroliza materii prime care conțin proteine naturale. Hidroliza materiei prime cu conținut de proteine (deșeuri alimentare și produse lactate) este încălzit cu soluții de acizi sau baze, la o temperatură de 100 - 105 ° C timp de 20 -. 48 de ore, cel mai frecvent folosit soluție 20% de hidroliză acid clorhidric a proteinei oferind profunde. In timpul racemizare hidroliza acidă produce proteine și distrugerea unora dintre aminoacizii lor constitutive. În triptofan hidroliză acidă complet distruse și numai pierderi semnificative de cisteină, metionină și tirozină (de 10 - 30%). Mai mult, pentru a accelera reacția de hidroliză a proteinelor cu ajutorul enzimelor proteolitice imobilizate și rășini schimbătoare de ioni. Aminoacizii obținuți prin hidroliză sunt utilizate în medicină, creșterea animalelor, industria alimentară și microbiologică.
Sinteza chimică. Folosind metoda de sinteză chimică a aminoacizilor din produsul dorit a fost obținut ca un amestec racemic de D- și L-forme stereoizomere. Marea majoritate a aminoacid natural se referă la L-serie. D- # 945-aminoacizi a găsit numai în compoziția glicoproteinele din pereții celulari ai bacteriilor, antibiotice si anumite toxine. Permeabilitatea L-aminoacizi într-o celulă de 500 de ori mai mare decât antipodul său. Stereospecificitate și transportul și metabolismul aminoacizilor. Separarea racematului altor aminoacizi - o procedură extrem de costisitoare și consumatoare de timp.
O excepție în acest sens este o metionină, care nestereoizbiratelen metabolismul, prin care acest aminoacid, de preferință, obținut prin sinteză chimică, care este economic mai avantajos în comparație cu metoda microbiologică.
Sinteza microbiologică. Sinteza cea mai promițătoare și benefică economic microbiană a aminoacizilor. Peste 60% din toate preparatele comercial înalt purificate produse în prezent de aminoacizi de proteină este preparat prin această metodă, care este un avantaj major în comparație cu metodele de sinteză chimică este posibilitatea de a produce L-aminoacizi pe baza materiilor prime regenerabile.
Cele mai multe tulpini sălbatice de microorganisme capabile să producă aminoacizi în mediu în cantități foarte mici. Printre posibilele organisme producătoare de acid glutamic marcat, dintre care 30% - drojdie, 30% - streptomicete, 20% - 10% din bacterii și ciuperci - microscopice.
tulpini producătoare promițători mutante prin îmbunătățirea continuă cu reproducere alterată program genetic și proprietăți de reglementare. Selecția commune producătorilor - microorganisme aparținând genurilor Brevibacterium, Micrococcus, Corynebacterium, Arthrobacter (Tabelul 8.1.).
Microorganisme - producători de aminoacizi
B. flavum, C. glutamicum
Dezvoltarea producând o schemă tehnologică singur aminoacid se bazează pe cunoașterea căilor și mecanismelor de reglementare a biosinteza unui aminoacid particular. dezechilibre metabolice, oferind necesare supraexprimării produsul din titlu, solicitat printr-o compoziție strict controlată și modificarea condițiilor de mediu.
producția de lizină. Pathway și caracterizarea producătorilor. Lizina celulelor microbiene este sintetizat din acid aspartic și produsul final este calea de biosinteză metabolice ramificat comune celor trei aminoacizi - lizină, metionină și treonină (Figura 8.2). În timpul formării de aminoacizi dintr-un strămoș comun, împreună cu lizina, există alți doi aminoacizi - metionină și treonină. În acest caz, efectul acumulării în mediu de numai un aminoacid țintă urmărit prin blocarea proceselor care conduc la sinteza secundară aminoacid care rezultă cale ramificată.
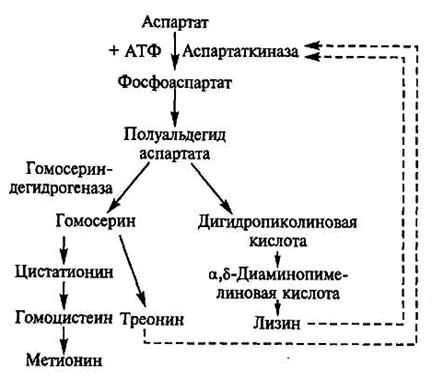
Enzima aspartokinase deschidere cale metabolică este o proteină alosterica sensibilă la inhibarea prin feedback-ul la acțiunea comună și coordonată produși secundari L treonina și lizina L-.
Figura 8.2. Schema lizină biosinteză, metionină și treonină la celulele glutamicum diphtheriae și flavum Brevibacterium
Odată cu acumularea de lizină și treonină în exces aspartokinase concentrație Ingi-biruetsya și sinteza lor se oprește la concentrații scăzute de oricare dintre cei doi aminoacizi proces activat.
Pentru a realiza ducație de lizină în cantități mari, sunt mutante de două tipuri. In mutanți primul tip nu este sintetizat sau nu funcționează homoserină, având ca rezultat sinteza blocat de metionină și treonină. Astfel de mutante sunt auxotrofica pentru homoserină sau treonină (metionină); Concentrațiile intracelulare ale treonina au redus semnificativ, care elimină blocarea aspartat.
Mutantii defect în al doilea tip genei structurale, determinare conformația aspartat kinazei. Ca urmare, enzima își pierde sensibilitatea la alosteric concentrațiilor de inhibitor - lizină.
Tehnologia de producție. Ca sursa de carbon pentru cultivarea unei lizina producătoare sunt utilizate materii prime secundare: melasă de sfeclă de zahăr, zer, amidon hidrolizat, lichior de sulfit. Sursele de azot sunt săruri de amoniu și uree. In plus, mediul nutritiv necesar pentru viața adăugată macro- și microelemente (P, Ca, Mg, Mn, Fe, etc.); promotori de creștere, care acționează ca extracte de porumb, drojdie, germeni de malț, tărâțele și hidrolizații de drojdie, vitamine din grupa B. Gradul de aerare este individual pentru a produce fiecare producător specific.
După terminarea procesului de fermentare (după 55 - 72 ore) faza lichidă este separată de cultura de celule de microorganisme prin filtrare și utilizat pentru a izola din acesta lizina.
Preparatele înalt purificate de lizină a fost obținută după fracționarea filtratului de cultură prin cromatografie de schimb ionic pe un schimbător de cationi. În acest scop, lizina este convertit într-o formă de cation:
Pentru acest proces, filtratul este tratat cu acid clorhidric până la pH 1.6-2.0. Cu două grupări ionice încărcate pozitiv, lizina ferm adsorbite pe rășină și eluat cu ea ca un singur compus 0,5 - soluție de hidroxid de amoniu 5%, după toate celelalte cationi. Eluatul a fost concentrat în vid la 60 ° C, transformată în forma de monoclorhidratul, apoi se usucă și se purifică în continuare prin recristalizare. Preparatele astfel obținute lizină cristalină 97-98% puritate -lea, care sunt utilizate pentru a îmbunătăți valoarea nutritivă a alimentelor și a industriilor medicale.
De asemenea, preparatele înalt purificate de lizină produse și alte tipuri de forme ale sale vandabile: lichid concentrat lizină (ZHKL), concentrat de furaj uscat de lizină (CCL) și preparatele pentru furaje foarte concentrate, caracterizate printr-un grad relativ mai scăzut de purificare în comparație cu primul medicament.
producția de triptofan. Pathway și caracterizarea producătorilor. Ca și triptofan lizină format în calea ramificat (ris.8.3).
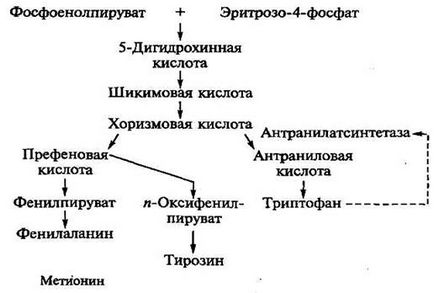
Ris.8.3. Calea metabolică a sintezei de triptofan
Cu toate acestea, utilizarea de mutanți auxotrofici care sunt reacții care conduc la sinteza de fenilalanină și tirozină în mediu blocat, acumularea excesivă de triptofan în mediu se observă, datorită caracteristicii de reglare a biosintezei triptofan în microorganisme. Metabolic triptofan precursor este acidul antranilic, care rezultă din acidul chorismic sub antranilatsintetazy. Triptofanul are un efect inhibitor asupra antranilatsintetazu, prin urmare, ocolesc controlul metabolic al sintezei în trepte a enzimei este indusă prin introducerea unui precursor - acidul antranilic.
În legătură cu această caracteristică a producției industriale de triptofan este organizată în principal, pe o schemă în două etape.
Tehnologia de producție. În prima etapă, sintetizat chimic al acidului antranilic care prin sistem enzimatic Candida utilis tulpini de drojdie mutante convertit la triptofan.
După uscarea culturii obținute concentrat pentru alimentare cu lichid triptofan (CCV), care cuprinde proteine, triptofan liber, vitaminele B1, B2 și PP. Preparatele înalt cristaline triptofan formate după purificare ulterioară a lichidului de cultură prin cromatografie de schimb ionic pe o coloană umplută cu rășină schimbătoare de cationi (sorbție la pH 1,0; eluare cu hidroxid de amoniu 5%, în amestec cu 2-propanol). Eluatele este cristalizat; Cristalele sunt spălate și uscate. Formularea cristalin cuprinde până la 99% din triptofan.
Mai mult metoda microbiologica triptofan utilizând precursorul preparate histidină, izoleucină, metionină, serină și treonină.
Chimică și metoda microbiologică. In ultimii ani, în producerea de aminoacizi folosesc din ce precursori biotransformare aminoacizi folosind enzime imobilizate sau celule de microorganisme obținute anterior prin mijloace chimice.
Utilizarea enzimelor în producerea aminoacizilor stereospecificitate furnizează procedee pentru sinteza lor, care distinge producția biotehnologică de produse chimice.
Prepararea L-lizină. Procedeul se bazează pe obținerea lizina stereospecifice hidroliză enzimatică (conversie) D-, L- # 945; # 949-amino-caprolactamă, care a fost preparat mai întâi chimic din ciclohexena:
Racematul este utilizat ca substrat care enzima L- # 945, # 949 amino; -kaprolaktamgidrolazy (lactamaza) este transformat în L-lizină, iar partea rămasă nereacționată (D-form) este tradus sub acțiunea racemaza în amestecul de antipozi:
Obținerea de triptofan. Metoda chimică-enzimatice pentru producerea triptofanul este condensarea directă a acidului piruvic indol și amoniac:
Catalizează tryptophanase piridoksalzavisimaya reacție. O enzimă care se găsește în bacterii E. coli, Bacillus Albei. Proteus rettgeri și se caracterizează printr-o specificitate de substrat larg. Adăugarea de triptofan pentru a induce formarea enzimei, și adăugarea de indol pentru a inhiba sinteza în bacterii, astfel încât procesul se desfășoară la o producătoare de amoniac în exces și triptofan piruvatului. Randament aminoacizi în aplicarea metodei-chimice enzimatice pentru producerea triptofan este de 63 g / l.
Lista de aminoacid țintă produs prin metoda chimică enzimatică este variată (acid L-aspartic, L-alanină, L-glutamină, L-lizină, L-tirozină, L-triptofan, L-cisteină, L-fenilalanină, L-metionină). proces chimic enzimatic în comparație cu microbiologice aminoacizi mai specifice nu necesită proceduri de purificare a produselor secundare și a fluxurilor de deșeuri. Cu toate acestea, costul materiilor prime și a preparatelor enzimatice este încă inferior unei metode microbiologice.
Utilizarea aminoacizilor. În afară de utilizarea ca aditivi alimentari, arome și amelioratori de aromă de aminoacizi utilizați ca materie primă în industria chimică, parfumerie și industria farmaceutică și la fabricarea unui număr de alte substanțe